Biochemie und Pathobiochemie: Phenylalanin-Stoffwechsel
Allgemeines
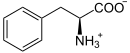
[Bearbeiten]Phenylalanin ist eine essentielle proteinogene, aromatische, hydrophobe Aminosäure. Sie kann zur Proteinbiosynthese und zur Biosynthese von Tyrosin verwendet werden.
Biosynthese von Tyrosin aus Phenylalanin
[Bearbeiten]| Kov. | All. | Koop. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| + Phosph. | - Trp, Tyr
+ Lysolecithin, Phospholipide |
+ Phe | Tetrahydrobiopterin, O2 | Fe |
|
1.14.16.1 | Ox | Phenyl- ketonurie (PKU) | ||||
Die Phenylalanin-Hydroxylase katalysiert die Hydroxylierung der essentiellen proteinogenen Aminosäure L-Phenylalanin zu L-Tyrosin unter Beteiligung von Tetrahydrobiopterin (BH4).
Pathobiochemie: Aus einem angeborenen Defekt der Phenylalaninhydroxylase resultiert das Krankheitsbild der klassischen Phenylketonurie. Die vermehrt gebildeten z.T. toxischen Alternativ-Metaboliten führen nach der Geburt unbehandelt zu einer schweren Beeinträchtigung der Gehirnentwicklung. Die verminderte Tyrosin-Bildung kann bei fehlender Zufuhr über die Nahrung zu einem Mangel an Schilddrüsenhormon, Melanin und Katecholaminen führen. Tyrosin wird hier zur essentiellen Aminosäure. Die Behandlung der PKU ist diätetisch. Das Diätregime wird im Erwachsenenalter bzw. nach Abschluß der Hirnentwicklung oft etwas weniger eng gehandhabt, allerdings folgt aus einer ungeplanten Schwangerschaft der PKU-betroffenen Frau bei nicht eingehaltener Diät die Schädigung des ungeborenen Kindes. Weitaus seltenere Störungen der Reaktion an der Phenylalanin-Hydroxylase (und an anderen Hydroxylasen, die aromatische Aminosäurenseitenketten hydroxylieren) können durch einen Mangel des Cofaktors Tetrahydrobiopterin bedingt sein, durch Defekte im Biopterin-Stoffwechsel (siehe BH4-defiziente Phenylketonurie).
Alternative Abbauwege des Phenylalanins
[Bearbeiten]Abbau zu Phenylenolpyruvat bzw. 2-Hydroxyphenylacetat
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| α-Ketoglutarat | α-Ketoglutarat | Pyridoxal- phosphat | Aspartat-Transaminase (ASAT, GOT) | 2.6.1.1 | Tr | ||||||
| Tyrosin-Transaminase | 2.6.1.5 | Tyrosinämie II (Richner-Hanhart-S.) | |||||||||
|
Phenylpyruvat-Tautomerase | 5.3.2.1 | Iso | ||||||||
| O2
CO2 |
Fe | 4-Hydroxyphenylpyruvat- Dioxygenase | 1.13.11.27 | Ox | Tyrosinämie III, Hawkinsinurie | ||||||
Phenylalanin verliert seine Aminogruppe durch pyridoxalabhängige Transaminierung und wird anschließend zu 2-Hydroxyphenylacetat decarboxyliert.
Dieser Abbauweg entspricht den ersten zwei Schritten des Tyrosinabbaus.
Abbau zu 2-Phenylacetat
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. |
|---|---|---|---|---|---|---|---|
|
CO2 |
Pyridoxal- phosphat | DOPA-Decarboxylase | 4.1.1.28 | Ly | AADC-Defizienz | ||
| H2O, O2
NH3, H2O2 |
FAD | Monoamino-Oxidase (MAO) | 1.4.3.4 | Ox | MAO A: Brunner-Syndrom, Antisozialität | ||
| Cu, TPQ | Diamino-Oxidase (DAO) | 1.4.3.6 | |||||
| H2O, NAD(P)+ | H2O, NAD(P)+ | Aldehyd-Dehydrogenase (ALDH) (NAD(P)+) | 1.2.1.5 | Ox | |||
Phenylalanin wird bei dieser Variante zuerst decarboxyliert und dann oxidativ desaminiert. Danach erfolgt die Oxidation zu 2-Phenylacetat.
Dieser Abbauweg entspricht dem alternativen Abbau von Tyrosin zu 4-Hydroxyphenylacetat.
Abbau zu 2-Phenylacetamid
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. |
|---|---|---|---|---|---|---|---|
| H2O2
CO2, 2 H2O |
|
Häm | Lactoperoxidase | 1.11.1.7 | Ox | ||
Weblinks
[Bearbeiten]- KEGG: Phenylalanine, tyrosine and tryptophan biosynthesis - Homo sapiens (human)
- KEGG: Phenylalanine metabolism - Homo sapiens (human)
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.