Biochemie und Pathobiochemie: Histidin-Stoffwechsel
Allgemeines
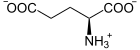
[Bearbeiten]L-Histidin ist eine nicht-essentielle proteinogene Aminosäure. Die basische Seitenkette enthält einen Imidazol-Ring, ein fünfgliedriger aromatischer Heterozyklus mit zwei Heteroatomen (Stickstoff). Wie alle proteinogenen Aminosäuren dient Histidin als Rohstoff zur Proteinbiosynthese. In Proteinen kann Histidin posttranslational zu 3-Methyl-Histidin methyliert werden. Viele Enzyme enthalten einen Histidyl-Rest im aktiven Zentrum. Im Hämoglobin ist ein Histidyl-Rest an der Komplexierung des Eisenatoms beteiligt.
Daneben kann die aromatische Aminosäure zum biogenen Amin Histamin decarboxyliert werden, das insbesondere von Gewebsmastzellen und basophilen Granulozyten synthetisiert und z.B. im Rahmen von IgE-vermittelten Immunreaktionen (Allergien, Parasitenabwehr) freigesetzt wird. Histamin wirkt bronchospasmogen und fördert die Stickstoffmonoxid-Freisetzung aus Endothelzellen. Im Magen stimuliert es die Säureproduktion. Im ZNS fungiert es als Neurotransmitter (Schlaf-Wach-Rhythmus, Brechreiz).
Wegen des pKs-Wertes der Seitenkette von ca. 6 liegt diese beim physiologischen pH von 7,4 protoniert und deprotoniert vor. So kann Histidin (bzw. das Protein) als Säure-Basen-Puffer wirken und bei enzymatischen Reaktionen Protonen abgeben und aufnehmen.
Im Hämoglobin besetzt ein Histidin-Rest die 5. Koordinationsstelle des Häm-Eisens.
Abbau von Histidin
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||
|
|
Histidase (Histidin-Ammoniak-Lyase) | 4.3.1.3 | Ly | Histidinämie | |||||||||||
|
|||||||||||||||
| H2O
|
NAD | Urocanase (Urocanat-Hydratase) | 4.2.1.49 | Ly | Urocanase-Def. | ||||||||||
|
|||||||||||||||
| H2O
H+ |
Imidazolonpropionase (Imidazolonpropionat-Hydrolase) | 3.5.2.7 | Hyd | ||||||||||||
|
|||||||||||||||
| THF | THF | Pyridoxal- phosphat | Glutamat-Formimidoyltransferase | 2.1.2.5 | Tr | FIGLU-urie | |||||||||
|
|||||||||||||||
Pathobiochemie: Bei Folsäuremangel oder Leberschaden ist die Abbaukapazität für Histidin vermindert. Bei hoher oraler Zufuhr der Aminosäure (FIGLU-Test, Histidinbelastungstest) wird dann vermehrt FIGLU im Urin ausgeschieden. Quelle: Roche Lexikon Medizin: FIGLU-Test
Biosynthese von Histamin und Abbau zu Imidazol-4-acetat
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||
|
|
Pyridoxalphosphat od. Pyruvat | Histidin-Decarboxylase | 4.1.1.22 | Ly | |||||||||||
| Pyridoxalphosphat | DOPA-Decarboxylase | 4.1.1.28 | AADC-Def. | ||||||||||||
|
|||||||||||||||
| H2O, O2
NH3, H2O2 |
Cu, TPQ | Diamino-Oxidase (DAO) | 1.4.3.6 | Ox | |||||||||||
|
|||||||||||||||
| H2O, NAD+ | Aldehyd-Dehydrogenase (NAD+) | 1.2.1.3 | Ox | ||||||||||||
|
|||||||||||||||
Auch hier taucht wieder eine Reaktionsfolge auf (Modifikation der Seitenkette durch Decarboxylierung, oxidative Deaminierung und Oxidation), die Sie schon vom Stoffwechsel der anderen aromatischen Aminosäuren her kennen.
Alternativer Abbau des Histamins zu Methylimidazolacetat
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| S-Adenosylmethionin | Histamin-N-Methyltransferase | 2.1.1.8 | Tr | |||||||
|
||||||||||
| H2O, O2
NH3, H2O2 |
FAD | Monoamino-Oxidase (MAO) | 1.4.3.4 | Ox | MAO A: Brunner-S., Antisozialität, Autismus | |||||
|
||||||||||
| H2O, NAD(P)+ | Aldehyd-Dehydrogenase (ALDH) (NAD(P)+) | 1.2.1.5 | Ox | |||||||
|
||||||||||
Weblinks
[Bearbeiten]
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.