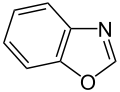
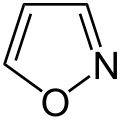
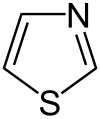
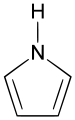
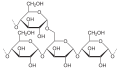
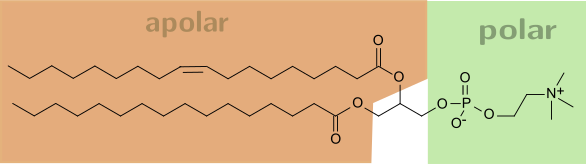
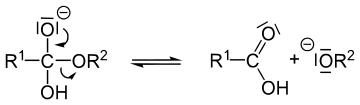
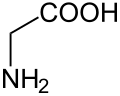
Organische Chemie für Schüler/ Druckversion
Kohlenstoffverbindungen
Wöhler entdeckt die Harnstoffsynthese
und begründet die Organische Chemie
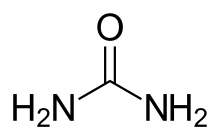
Harnstoff ist ein weißer, kristalliner, geruchloser Feststoff. Er entsteht im Körper von Menschen oder Tieren, wenn Eiweiße aus der Nahrung abgebaut werden. Zusammen mit Wasser verlässt der Harnstoff den Körper als Urin. Aufgrund seines hohen Stickstoffgehaltes ist Harnstoff weltweit das bedeutendste Stickstoffdüngemittel.
Vor 200 Jahren glaubte man, er sei nur auf natürlichem Wege, also organisch herzustellen. Für organische Stoffe sei eine „Lebenskraft“ notwendig (die damals so genannte Vis Vitalis). Der deutsche Chemiker Friedrich Wöhler (1800 - 1882) widerlegte diese Ansicht. Im Jahr 1828 stellte er im Labor Harnstoff aus anorganischen Ausgangsstoffen künstlich her. Da niemand dies für möglich hielt, war Wöhler selbst von dem Ergebnis beeindruckt. So schrieb er bald darauf an seinen Freund Berzelius:
- Friedrich Wöhler
„Lieber Herr Professor!
Obgleich ich sicher hoffe, daß mein Brief vom 12. Januar und das Postskript vom 1. Februar bey Ihnen angelangt sind und ich täglich oder vielmehr stündlich in der gespannten Hoffnung lebe, einen Brief von Ihnen zu erhalten, so will ich in doch nicht abwarten, sondern schon wieder schreiben, denn ich kann, so zu sagen, mein chemisches Wasser nicht halten und muß Ihnen sagen, daß ich Harnstoff machen kann, ohne dazu Nieren oder überhaupt ein Thier, sey es Mensch oder Hund, nöthig zu haben. Das cyansaure Ammoniak ist Harnstoff. Vielleicht erinnern Sie sich noch der Versuche, die ich in der glücklichen Zeit, als ich noch bey Ihnen arbeitete, anstellte, wo ich fand, daß immer, wenn man Cyansäure mit Ammoniak zu verbinden sucht, eine krystallisirte Substanz entsteht, die sich indifferent verhielt und weder auf Cyansäure noch Ammoniak reagierte. Beim Durchblättern meines Journals fiel mir dies wieder auf, und ich hielt es für möglich, daß durch die Vereinigung von Cyansäure und Ammoniak die Elemente, zwar in derselben Proportion, aber auf eine andere Art zusammentreten könnten und hierbey vielleicht z.B. eine vegetabilische Salzbase oder etwas Ähnliches gebildet werden könnte.“
Die Tragweite der Entdeckung, zeigte sich auch darin, dass Wöhler noch im gleichen Jahr, im Alter von 28 Jahren zum Professor in Berlin ernannt wurde. 1832 wechselte er dann nach Kassel und wurde 1836 Leitender Professor für Chemie und Pharmazie an der Universität Göttingen. Dort arbeitete er auch mit Justus von Liebig zusammen. Sie veröffentlichten eine gemeinsame Arbeit:
- Friedrich Wöhler, Justus von Liebig: „... die Erzeugung aller organischen Materien in unseren Laboratorium ist nicht allein wahrscheinlich, sondern muss als gewiss betrachtet werden. Zucker, Salicin, Morphin werden künstlich hervorgebracht werden. Wir kennen freilich die Wege noch nicht, auf dem dieses Endresultat zu erreichen ist, weil uns die Vorderglieder unbekannt sind, aus denen diese Materien sich entwickeln, allein wir werden sie kennen lernen.“
Bis zu seinem Tod im Jahre 1882 wirkte und lehrte Wöhler in Göttingen. Seine Vision wurde schnell Wirklichkeit. Viele organische Substanzen wurden in den folgenden Jahren auch im Labor hergestellt. Eine Trennung von anorganischer und organischer Chemie war nun im Grunde überflüssig.
Dass diese Trennung dennoch bis heute beibehalten wurde (obwohl die Grenzen fließend sind!) ist also eher historisch zu verstehen. Allerdings ist allen organischen Molekülen eines gemeinsam. Sie enthalten Kohlenstoffatome! Neben den auch immer enthaltenen Wasserstoffatomen, findet man einige Sorten von Elementen, die nicht immer aber in einigen organischen Stoffen enthalten sind, nämlich Stickstoff-, Sauerstoff-, Schwefel-, oder Phosphoratome. Man bezeichnet sie auch als Heteroatome.
Übrigens ist es auch heute noch immer nicht möglich, alle Moleküle aus pflanzlichen oder tierischen Organismen künstlich herzustellen. Stattdessen werden sie aus Pflanzen und Tieren isoliert und man nutzt genmanipulierte Bakterien, die als Bio-Fabriken dienen.
Dafür gibt es zahlreiche neue organische Verbindungen, die sich in keinem Lebewesen finden lassen. Man nennt sie synthetisch, also künstlich hergestellt. Solche sind zum Beispiel Kunststoffe, Medikamente usw...
Zusatzinformationen:
Kohlenstoffverbindungen in der Natur - Der Kohlenstoffkreislauf

Kohlenstoff findet sich in der Natur zum einen in drei großen, miteinander im Austausch stehenden Reservoiren:
- in der Atmosphäre als Kohlenstoffdioxid
- in der Land-Biosphäre, als lebende und tote Pflanzen und Tiere
- im Ozean als gelöstes Kohlenstoffdioxid
Daneben gibt es noch Steine und Gebirge und Betonhäuser, in denen auch viel Kohlenstoff drinnen ist. Sie tragen langsam zum Kohlenstoffkreislauf bei. Die Atmosphäre, Biosphäre und der Ozean tauschen schnell untereinander Kohlenstoffprodukte aus, zB Kohlenstoffdioxid.
Die Atmosphäre, also die Luft, gibt an die Biosphäre etwa 120 Milliarden Tonnen Kohlenstoff pro Jahr (GtC/yr) ab, das z.B. Pflanzen zu Äpfeln verarbeiten. Tiere der Biosphäre, etwa Bakterien und auch Menschen, essen Äpfel und verarbeiten den Kohlenstoff aus dem Apfel mit der Atmung zu Kohlenstoffdioxid. Bakterien tun Ähnliches auch im Boden. Insgesamt gelangen so 120 Gt Kohlenstoff pro Jahr wieder zurück in die Atmosphäre.
Kohlenstoffdioxid aus der Atmosphäre kann sich im Wasser auflösen. Es wird dann Kohlensäure, wie im Mineralwasser. Dann bildet es weitere anorganische Stoffe. Es kann sich aber auch wieder auflösen, wie ein Glas Mineralwasser, das lange am Tisch steht. Es wird wieder gasförmig und gelangt vom Ozean in die Atmosphäre. Der Kohlenstofftransport in beide Richtungen beträgt etwa 90 GtC pro Jahr.
Andererseits kann ein Blatt von einem Baum, ein Kohlenstoffträger, über die Flüsse in den Ozean gelangen. So gelangt Kohlenstoff von der Biosphäre in den Ozean. Das Blatt wird vielleicht von einem Fisch gefressen, der stirbt und am Grund des Ozeans ein kalkhaltiges Skelett hinterlässt. Pro Jahr werden auf diese Art 0,2 GtC als Sedimente abgelagert. Sie könnten in tausenden Jahren zu einem Gebirge werden oder zu einem Betonbaustein.
Weitere Hinweise:
- Destruenten sind Zerkleinerer und Bakterien. Sie zersetzen Blätter, Pflanzenreste, und tote Tiere. Dabei entstehen Mineralsalze, Wasser und Kohlenstoffdioxid.
- Bei Stoffwechselvorgängen in Mensch und Tier (durch die Kohlenhydratverdauung) und bei der Verbrennung von fossilen Brennstoffen wie Benzin und Diesel, entstehen auch Kohlenstoffdioxid, und auch Wasser. Das Wasser kann man im Winter am Auspuff und beim Ausatmen sehen.
- Die Stoffkreisläufe sind geschlossen, alle Stoffe (wie Kohlenstoff, Sauerstoff, Wasser und Mineralsalze) werden immer wieder verwendet. Der Energiekreislauf ist nicht geschlossen. Es muss ständig neue Energie dem System zugeführt werden. Dies geschieht durch die Sonne. Der Grund ist ein permanenter Verluste durch Wärmeabgabe, z.B. in den Weltraum sowie der Energiebedarf für Lebensvorgänge und der daraus entstehenden Wärme, die ebenfalls verloren geht.
- Sauerstoff wird in Mensch und Tier durch die Atmung in Kohlenstoffdioxid umgewandelt. Dazu sind Kohlenhydrate notwendig. Kohlenstoffkreislauf und Sauerstoffkreislauf haben also eine Verbindung!
Zusatzinformationen:
Untersuchung organischer Stoffe
Versuchsaufbau (V) 1: Zucker, Mehl, Kartoffelstückchen, Plastik, Kerzenwachs, Öl, Petroleum werden in Reagenzglasern stark erhitzt (und mit einem Kohlestückchen verglichen!).
Versuchsaufbau (V) 2: Die Stoffe werden in einem Tiegel entzündet. Wenn sie brennen, sofort wieder löschen!
| Stoff | Beobachtung „Erhitzen“ | Beobachtung „Verbrennung“ | Sonstiges |
|---|---|---|---|
| Zucker | |||
| Mehl | |||
| Kartoffelstückchen | |||
| Plastik | |||
| Kerzenwachs (Paraffin) | |||
| Öl | |||
| Petroleum | |||
| Spiritus | C2H5OH + 3 O2 → 2CO2 + 3 H2O + E |
Beobachtung (B): Die untersuchten Stoffe verkohlen und werden in der Regel schwarz
Schlussfolgerung (S): Alle organischen Verbindungen enthalten Kohlenstoff, was daran erkennbar ist, dass sich die Stoffe beim Erhitzen schwarz färben.
Man versteht deshalb die Organische Chemie auch als Chemie der Kohlenstoffverbindungen.
Der Chemiker Berzelius teilte die Chemie 1806 in zwei Bereiche ein:
- anorganische Chemie (Stoffe aus der unbelebten Natur)
- und organische Chemie (Verbindungen pflanzlicher und tierischer Herkunft)
Qualitative Analyse organischer Stoffe
Bei der Qualitative Analyse werden die Elemente, aus denen ein Stoff aufgebaut sind, durch bestimmte Methoden und Nachweis-Reaktionen, gesucht.
Kohlenstoff-Nachweis
V: Ein Stück Kohle oder ersatzweise ein anderes organisches Produkte, wie Pflanzenreste sowie Pflanzenprodukte wie Mehl, Mehlprodukte, Kartoffeln usw.… werden stark erhitzt, eventuell unter Sauerstoff-Zufuhr. Das entstehende Gas wird in Kalkwasser geleitet.
Aufbau
| B: | S: |
| Die organischen Produkte färben sich alle beim starken Erhitzen schwarz | → Beim Zersetzen der organischen Verbindungen entsteht Kohlenstoff |
| Das Kalkwasser wird trübe | → Es ist CO2 entstanden, das im Kalkwasser zur Ausfällung von Calciumcarbonat führt. C + O2 → CO2 + E |
Wasserstoff-Nachweis
V: Ähnlich wie vorher, aber: Das entstehende Gas wird durch wasserfreies Kupfersulfat oder Kobaltchlorid geleitet.
| B: | S: |
| Tröpfchen setzen sich an der kalten Glaswand ab. | → kein eindeutiger Nachweis! |
| Das weiße Kupfersulfat wird schwach blau bzw. das rosafarbene Kobaldchlorid wird blau. | → Bei der Verbrennung bzw. beim Erhitzen entsteht Wasser, das durch die Reaktion von im Stoff gebundenen Wasserstoff mit Sauerstoff entstanden sein muss. |
WICHTIG: Bei jeder Verbrennung organischer Substanzen entsteht Wasser. So kann man den Wasserdampf, der aus dem Auspuff des Benzinmotors kommt erkennen und auch beim Ausatmen wird vom Menschen Wasserdampf mit ausgeatmet. Im Menschen werden die Kohlenhydrate
Man versteht deshalb die Organische Chemie auch als Chemie der Kohlenwasserstoffverbindungen
Weitere Analysen organischer Verbindungen:
Neben Kohlenstoff und Wasserstoff enthalten organische Verbindungen häufiger noch einige andere Elemente, die folgendermaßen nachgewiesen werden können:
- Stickstoff: Nachweis durch Kochen mit Natronlauge. Es bildet sich Ammoniak, welches typisch riecht und Indikatorpapier blau färbt.
- Schwefel: Erhitzen von schwefelhaltigen Substanzen färbt Bleiacetatpapier sowie Bleinitrat- oder Bleiacetatlösung schwarz. (Hintergrund: Beim Erhitzen bildet sich H2S, welches mit Bleiionen das schwarze PbS bildet)
- Halogene (Fluor, Chlor, Brom, Iod): Auf einem ausgeglühten Streifen Kupferblech werden die Testsubstanzen in die rauschende, blaue Brennerflamme gehalten (z.B. ein Stück PVC). Man beobachtet eine grüne Flamme. (Hintergrund: Halogenionen verbinden sich mit Kupfer zu Kupferhalogeniden (z.B. CuF2, CuCl2 usw.. Diese färben die Brennerflamme beim Verdampfen grün).
- Phosphor: ...
- Sauerstoff: Sauerstoff lässt sich nicht einfach nachweisen, denn beim Verbrennen wird ja Sauerstoff aus der Luft benötigt und so ist der Nachweis einer sauerstoffhaltigen Verbindung als Verbrennungsprodukt kein Nachweis. Im Labor könnte man indirekt das Vorhandensein von Sauerstoff nachweisen, indem man den Stoff quantitativ untersucht und anhand der Differenz zwischen untersuchter Stoffmenge und nachgewiesenem Inhalt, einen weiteren Stoff erkennen kann.
- Mit Hilfe von modernen Untersuchungsmethoden lässt sich das Vorhandensein von Sauerstoff aber auch direkt nachweisen.
Entzündung von organischen Stoffen II
V: Wundbenzin, Petroleum, Speiseöl und Ethanol werden in einen Porzellantiegel gegeben und die Dämpfe werden vorsichtig zugefächelt. Es wird versucht, die Dämpfe zu entzünden. (Petroleum und Speiseöl notfalls sehr vorsichtig erhitzen). Es wird dann eine Vorhersage zur Flüchtigkeit der Stoffe getroffen
B: Die meisten Verbindungen lassen sich leicht entzünden. Ihre aufsteigenden Gase lassen sich leicht entzünden.
S: Die meisten organischen Verbindungen sind gut brennbar, auch wenn ihre Entzündungstemperaturen verschieden sind. Oft reicht schon ein Funke um Verbindungen wie Benzin, Aceton, Ether oder Alkohole zu entzünden. Hiervon geht eine große Gefahr der organischen Verbindungen aus. Im Labor umgeht man diese oft, indem man flammenlos erhitzt, z.B. mit elektrischen Heizplatten. Im Alltag sollte man nicht rauchen, wenn man mit organischen Stoffen Umgang hat (Z.B. beim Tanken oder beim Arbeiten mit Lösungsmitteln und Verdünnern!).
Unter der Entzündungstemperatur versteht man die Temperatur, bei der sich ein Stoff selbst entzündet.
Löslichkeit organischer Stoffe
V: Zucker, Mehl, Kartoffelstückchen, Plastik, Kerzenwachs, Öl, Petroleum werden mit Wasser (bzw. mit Benzin) versucht zu lösen
B: Nur der Zucker löst sich in Wasser auf
Organische Stoffe sind meist apolar (=unpolar), d.h. sie lösen sich nicht in Wasser auf, sondern nur in unpolaren Stoffen, wie Benzin.
Deshalb kann Benzin auch viele Flecken entfernen, die man mit der Waschmaschine nicht entfernen kann.
Vorbereitung quantitative Analyse: Wiederholung chemisches Rechnen (Klasse 9)
a) Die Avogadro Zahl:
Der Chemiker Avogadro benötige eine Zahl, um große Mengen von Atomen beschreiben zu können und um schließlich damit auch „vernünftig“ rechnen zu können.
b) Die Masse von Atomen:
Als Chemiker will man natürlich dann auch wissen, was denn jetzt eigentlich so ein Atom wiegt?
Z.B.: ein Cu-Blech wiegt 0,8g. Eine Messung ergibt, es enthält genau 6,022 1023 Atome (=1mol)
→ ein Atom wiegt: m(Cu-Atom) = 0,8 g : 6,022 1023 Atome = 1,055 10-22 g/Atome
Diese Zahl ist natürlich absolut unhandlich und viel zu klein, um damit zu rechnen. Die Chemiker benannten die neue Einheit schließlich mit dem englischen Wort für Einheit „unit“
c) Die Dichte
Die Dichte ist eine Stoffeigenschaft.
- ρ = m/V
Durch Wiegen eines Körpers und seiner Verdrängung von Wasser kann die Dichte leicht bestimmt werden. Es gilt: 1 g/cm3 = 1000 kg/m3.
d) Die molare Masse
Sicher hast Du Dich nun schon gefragt, woher Chemiker überhaupt wissen, wie viele Atome z.B. in einem Stück Kohle enthalten sind? Vielleicht hilft Dir ein Vergleich, um auf die Lösung zu kommen:
Vergleich: Wie kann man bestimmen, wie viele (gleiche) Centmünzen in einer Streichholzschachtel sind, ohne diese zu öffnen oder die Cent einzeln abzuzählen?
Richtig, man kann sie wiegen! Wenn Du die Masse einer Münze kennst, kannst Du leicht die Anzahl in der Streichholzschachtel durch Division bestimmen:
- Anzahl Münzen = Masse aller Münzen / Masse einer Münze
Nun ein chemisches Beispiel: Wie viele Atome sind in 12g Kohlenstoff enthalten?
Man hat also 12g Kohlenstoff, (z.B. ein kleines Stück Kohle). Man kennt die Masse, möchte wissen wie viel Atome es sind.
- M = molare Masse [g/mol] (=Umrechnungsfaktor zwischen Masse und Stoffmenge[2])
- m = Masse in g
- n = Stoffmenge (also Anzahl an Atomen in mol)
- m = M · n → n = m/ M
Der Zahlenwert der molaren Masse kann leicht aus dem PSE abgelesen werden. Er entspricht dem Wert der Atom- (bzw. Molekül-) Masse:
→ 1 mol Kohlenstoff hat die molare Masse 12,001 g/mol
→ 12,001 g C entsprechen 1mol
→ 1mol = 6,022·1023 Atome (=602 200 000 000 000 000 000 000 Atome Kohlenstoff sind enthalten!)
e) molare Masse bei Verbindungen
Auch für Verbindungen kann die Molare Masse angegeben werden. Sie ergibt sich einfach durch
Addieren der Atommassen der Elemente, die in einer Verbindung enthalten sind,
z. B. Bestimme die relative Molekülmasse von Wasser (von Zucker)
- M(H2O) = 2 → 1,008u + 16u = 18,016u
- M(C6H12O6) = 6 M(C) + 12 M(H) + 6 M(O)
- = (6 · 12 + 12 · 1 + 6 · 16) g/mol
- = 180 g/mol
Zusatzinformationen: molare Masse Mol (Stoffmenge) Avogadrosches Gesetz
Gay Lusac: Umrechnung zw.. Normalbedingungen & herrschenden Bedingungen im Labor
- =p1 · V1 p2 · V2
- T1 · n1 T2 · n2
Aus dieser Umrechnung kann man das Gesetz der allgemeinen Gasgleichung ableiten:
- p·V = n · R · T
- R = 8,314472 J/ (mol · K) (=universelle Gaskonstante)
Zusatzinformationen
Aufgaben
- Wie groß ist die molare Masse von: C, H, O, H2O, HCl, H3PO4, C8H14?
- Du kennst nun die Anzahl an Atomen in einem 12g schweren Kohlenstoffstückchen, aber wie viel Atome sind in einem 10mal so schweren Kohlestückchen enthalten? Notiere bitte die Zahl ;-)
- Wie viel Moleküle sind in 1 Teelöffel Zucker (C6H12O6) enthalten? (1 Teelöffel entspricht 5g)
- Welcher Stoffmenge ist in einer mit Wasser gefüllten Badewanne (200l) enthalten? (Dichte von Wasser: ρ = 1g/ ml)
- Befinden sich mehr Atome in 1 kg Gold oder in 150g Aluminium?
Quantitative Analyse von Propanol nach Liebig
Eine quantitative Analyse ist ein chemisches und/oder physikalisches Verfahren, bei der es um die Beantwortung der Frage geht, wie viel von einem Stoff in einer gegebenen Probe vorhanden ist.
V: in einem Glasrohr wird Propanol (eigentlich ein unbekannter Stoff, aber zum Verständnis des Verfahrens, wird erstmal ein bekannter genommen) oxidiert. Es stehen 0,500 g Propanol zur Verfügung.
Vor Versuchsbeginn werden sowohl das Gewicht des Glasrohrs mit dem CaCl2 bestimmt (das soll später Wasser auffangen) als auch das Gewicht der Gaswaschlasche mit dem KOH (diese „fängt CO2 auf)
Mit dem Brenner wird die Reaktion gestartet und nach erfolgter Oxidation des unbekannten Stoffes (also hier des Propanols), wiegt man das Glasrohr und die Waschflasche erneut.
a) Bestimmen der Verhältnisformel
Aus den Masse an H2O bzw. CO2 lassen sich die Massen der in der Verbindung vorhandenen Elemente (C, H) durch ein einfaches Verhältnis mit den Atommassen bestimmen. Die Masse an Sauerstoff, wird dann durch Subtraktion von der Masse an eingesetztem Propanol bestimmt.
a) Bestimmung mKohlenstoff: \frac{m(CO_2)}{M(C) \cdot Anzahl \ C-Atome}</math>
Im Versuch wurden 1,100g CO2 gemessen
- →
- = 0,3g C
b) Bestimmung von mWasserstoff:
Im Versuch wurden 0,600g H2O gemessen
- →
- =0,066g H
c) Bestimmung m Sauerstoff: m Propanol = m Kohlenstoff + m Wasserstoff + m Sauerstoff
→ m Sauerstoff = m Propanol - (m Kohlenstoff + m Wasserstoff)
→ m Sauerstoff = 0,5g - (0,300g + 0,066g)
- = 0,134g O
Massenwerte nützen nur leider wenig, da verschiedene Elemente ja unterschiedliche Massen haben. Eine Umrechnung auf die Stoffmenge (Anzahl der Atome!) ist notwendig!
d) Umrechnung: Stoffmenge n = m/ M
- n Kohlenstoff = 0,300g / 12g/mol = 0,025mol
- n Wasserstoff = 0,066 / 1g/mol= 0,066mol
- n Sauerstoff = 0,134g / 16g/mol= 0,008mol
Die drei Werte lassen sich nun prima ins Verhältnis setzen, so dass eine Verhältnisformel entsteht:
| n C | n H | n O | |
| 0,025 | 0,066 | 0,008 | :0,008 |
| 3 | 8 | 1 |
→ die Verhältnisformel von Propanol ist C3H8O1
b) Bestimmen der Summenformel von Propanol
Eine Verhältnisformel beschreibt noch nicht die tatsächliche Formel einer Verbindung. Propanol könnte die Summenformel C3H8O1 oder aber auch C6H16O2 oder alle anderen Möglichkeiten nach der Formel N · (C3H8O1) haben!
Nur durch Kenntnis der molaren Masse kann man die genaue Summenformel bestimmen. Bei Gasen ist die Verwendung der Formel des molaren Volumens eine einfache Lösung dieses Problems:
- Dazu sind drei Rechenschritte nötig
- Molares Volumen: 1mol eines Gases bildet (bei Normalbedingungen[3]) 22,4l Gas
- Molare Masse
- Gleichsetzen der beiden Formeln:
Ein so berechnetes M wird nun mit dem berechnetem Wert aus a) vergleichen. Er sollte gleich, oder ein Vielfaches sein.
- Also
- In a) wurde durch die Verhältnisformel bestimmt: C3H8O1 → M(C3H8O1) = 60g/mol
- In b) wurde M berechnet: M = 60 g/mol
Da beide Ergebnisse gleich sind, folgt: N·(C3H8O1) = M berechnet = 60 g/mol = N · 60 g/mol → N = 1 → C3H8O1 ist bereits die korrekte Formel!
Weitere Beispielaufgabe für den letzten Schritt:
1. Die Verhältnisformel einer unbekannten Verbindung ergibt: C1H3
Die Ermittlung der molaren Masse ergibt: 30g/mol
→ die korrekte Formel ist
N·(MC + MH + MH + MH) = 30g/mol
N·(12g/mol + 1g/mol + 1g/mol + 1g/mol) = 30g/mol|:15
N = 30/15 = 2
→ die korrekte Formel ist C2H6
Zusatzinformationen
Quantitative Analyse Kategorie:Chemisches Analyseverfahren
Aufgaben
- Bei einer quantitativen Analyse nach Liebig wurden für 0,5g einer unbekannten Verbindung folgende Werte gemessen: 1,100g CO2 , 0,600g H2O. Bestimme die Verhältnisformel.
- Die Verhältnisformel einer unbekannten Verbindung ergibt: C1H3. Die Ermittlung der molaren Masse ergibt: 30g/mol. Bestimme die korrekte Summenformel
- Eine unbekannte Verbindung wird analysiert. Sie wiegt 26g und nimmt bei Normalbedingungen (T = 273,15K entspricht 0 °C und Druck p = 101325 Pa entspricht 1013,25 mbar) ein Volumen von 7.4666 l ein. Die Verhältnisformel ergibt C1H1. Wie lautet die Summenformel?
- 1,50g einer unbekannten pflanzlichen Verbindung werden analysiert. Die Analyse ergibt 2,2g CO2 und 0,9g H2O.
- a) Bestimme die Verhältnisformel
- b) Das es sich nicht um ein Gas handelt, kann man die molare Masse nicht durch das molare Volumen bestimmen. Man weiß aber aus Untersuchungen, dass 1,470mol eine Masse von 250g haben. Bestimme die molare Masse und somit die Summenformel.
- Wie weist Du Stickstoff, Schwefel, Kohlenstoff und Wasserstoff in organischen Verbindungen nach? Erkläre kurz.
- Lösungen
- Siehe Beispielaufgabe „Propanol“
- M(C1H3) = 15g/mol → die korrekte Summenformel lautet: C2H6
- m = 26g
V = 7.4666L
Verhältnisformel = C1H1.
Summenformel = ? → gesucht ist M (CxHx)
→M = 22,4 l/mol · 26g / 7,4666l = M (CxHx) = 78 g/mol
→M (C1H1) = 13g/mol (C= 12 g/mol, H = 1 g/mol)
→ die korrekte Formel lautet C6H6- a) C1H2O1
- b) C6H12O6 (=Glucose, ).
- Stickstoff: Nachweis durch Kochen mit Natronlauge. Es bildet sich Amoniak, welches typisch riecht und Indikatorpapier blau färbt. Schwefel: Erhitzen von Schwefelhaltigen Substanzen färbt Bleiacetatpapier sowie Bleinitrat- oder Bleiacetatlösung schwarz. (Hintergrund: Beim Erhitzen bildet sich H2S, welches mit Bleiionen das schwarze PbS bildet)
Halogene (Fluor, Chlor, Brom, Iod): Auf einem ausgeglühtem Streifen Kupferbleich werden die Testsubstanzen in die rauschende, blaue Brennerflamme gehalten (z.B. ein Stück PVC). Man beobachtet eine grüne Flamme. (Hintergrund: Halogenionen verbinden sich mit Kupfer zu Kupferhalogeniden (z.B. CuF2, CuCl2 usw.). Diese färben beim Verdampfen die Brenner-flamme grün.
Analyse von Feuerzeuggas
Aufgabe: Bestimme in Gruppenarbeit, welches Gas in Feuerzeug enthalten ist
Tipp: Es handelt sich um ein Alkan!
- a) Planung des Versuches
Es kann nur ein Gas sein, deshalb kann es nur Methan, Ethan, Propan oder Butan sein.
Um das Gas genau bestimmen zu können, muss die molare Masse (M) bestimmt werden.
Da Vm bekannt ist (22,4l/mol), muss man für die Analyse nur noch die Masse (durch wiegen des Feuerzeugs, vor und nach dem Versuch) und das Volumen (durch Füllen des Reaktionsgefäßes mit Wasser und anschließendem Ausmessen) bestimmen.
- b) Durchführung
Die praktische Durchführung bietet einige Hindernisse. Das Feuerzeuggas wird am besten in einen mit Wasser gefüllten Rundkolben gefüllt. Von diesem wird vorher das Volumen mit Hilfe eines Messzylinders bestimmt.

Siehe auch gute Versuchsanleitungen auf: Universelle Gaskonstante
Luftverschmutzung durch Verbrennung von Kohlenstoffverbindungen und die Konsequenzen
a) Luftverschmutzung

b) Erderwärmung durch den Treibhauseffekt

Übermäßiger Kohlenstoffdioxidausstoß verstärkt den Treibhauseffekt. Zusatzinformationen:
Wiederholungsaufgaben
- Erkläre das Zustandekommen des Treibhauseffektes. Welche Gase sind beteiligt? Wie entstehen Sie?
- Treibhauseffekt und Ozonloch werden in der Bevölkerung gerne gleichgesetzt, obwohl sie komplett verschiedene Ursachen und Auswirkungen haben. Dennoch scheinen sie sich gegenseitig zu verstärken. Kannst Du erklären wie?
- ↑ 'Das entspricht 6 Milliarden • 1Milliarde • 100000
- ↑ entspricht der Masse eines Centstücks im oberen Bsp.
- ↑ Das molare Volumen eines jeden (idealen) Gases beträgt 22,413996 l/mol unter Normalbedingungen (also 0°C und 1013,25 hPa) und 24,4640424 l/mol bei Standardbedingungen (also 25°C und 1013,25 hPa).
Kohlenstoff als Bindungspartner
Die Atombindung bei Wasserstoff & Kohlenstoff
-
Punkt-Kreuz-Diagramm
-
CH4
-
2 e- sind jeweils ein Strich
Ionen gibt es nur in Kristallen oder gelöst in Wasser. Bei Kohlenwasserstoffen liegt beides nicht vor.
Sie verbinden sich mit einer anderen Methode, der Atombindung. Dazu überlappen die äußeren Elektronenwolken und bilden einen gemeinsamen Bereich (dieser wird auch Molekülorbital genannt[1]). Damit gehört das Valenzelektronen-Paar beiden Atomen in gleicher Weise und sie erhalten Edelgaskonfiguration.
Vom Kohlenstoffatom gehen in der Regel 4 Elektronenpaarbindungen ab (oder es liegen Doppel- oder Dreifachbindungen vor, dann sind es entsprechend weniger). Meistens ist Kohlenstoff dabei mit Kohlenstoff oder mit Wasserstoff verknüpft (aber auch Sauerstoff, Schwefel und Stickstoff (u.a.) sind möglich). Je länger dabei eine Kohlenstoffkette ist, desto fester und dickflüssiger wird eine Substanz.
Tipp: Bei Problemen mit dem Erstellen von Atombindungen, lies nochmals das Arbeitsblatt „Regeln zum Erstellen von Valenzstrichformeln“ im Kapitel „Atombindung“.
Kohlenstoff als Bindungspartner
Kohlenstoff ist ein Element der 4. Hauptgruppe, d.h. es hat vier Außenelektronen. Es fehlen also 4 Valenzelektronen zum Erreichen der Edelgaskonfiguration. Das Ausbilden von 4 Atombindungen bietet sich an, um diesen Zustand zu Erreichen. Dabei bilden die Außenelektronen des Kohlenstoffatoms mit den Außenelektronen der Reaktionspartner gemeinsame Bindungselektronenpaare. Am stabilsten sind dabei Kohlenstoff-Kohlenstoff-Bindungen.
-
Butan
-
iso-Pentan
-
Cyclo-Hexan
Beim Verbrennen organischer Substanzen wird viel Energie freigesetzt. Diese stammt aus den Bindungen und wird von den Menschen bei der Verbrennung fossiler Brennstoffe (Erdöl, Erdgas), Holz und Kohle genutzt. Auch die Verbrennung von Kunststoffen in Müllverbrennungsanlagen setzt diese Energie frei. Kein Wunder, denn auch Kunststoffe sind Kohlenwasserstoffverbindungen.
Kettenförmige Kohlenwasserstoffe (ohne Mehrfachbindungen) nennt man Alkane. Ringförmige entsprechend Cycloalkane. Ketteförmige Kohlenwasserstoffe mit Doppelbindungen, werden Alkene, mit Dreifachbindungen Alkine genannt.
Die einfache Verknüpfung von Kohlenstoff mit anderen Nichtmetallen über Atombindungen ermöglicht eine schier unendliche Anzahl an möglichen Kombinationen. Mehr als 5 Millionen sollen in der Natur zu finden sein! Im Labor entstehen täglich neue.
Obwohl in der anorganischen Chemie viel mehr Elemente reagieren, sind bisher nur ca. 150 000 Verbindungen bekannt. Im Vergleich dazu schätzt man die Anzahl an organischen Verbindungen auf ca. 10 Millionen.
Ausnahmen: Kohlenstoffverbindungen, die als anorganisch gelten.
- Oxide des Kohlenstoffs (z.B. CO, CO2)
- Kohlensäure (H2CO3)
- Salze der Kohlensäure (z.B. Kalk CaCO3)
Die homologe Reihe der Alkane
Zusatzinformationen:
Eigenschaften der Alkane - Schmelz- und Siedepunkte
| Kettenlänge | Name | Smp. [°C] | Sdp. [°C] | Kettenlänge | Name | Smp. [°C] | Sdp. [°C] |
|---|---|---|---|---|---|---|---|
| CH4 | Methan | -183 | -161 | C16H34 | Hexadekan | 18 | 287 |
| C2H6 | Ethan | -183 | -88 | C17H36 | Heptadekan | 21 | 302 |
| C3H8 | Propan | -189 | -42 | C18H38 | Oktadekan | 29 | 317 |
| C4H10 | Butan | -138 | -0,5 | C19H40 | Nonadekan | 33 | 330 |
| C5H12 | Pentan | -130 | 36 | C20H42 | Eicosan | 36,7 | 343 |
| C6H14 | Hexan | -95 | 69 | C21H44 | Henikosan | 40,5 | 356 |
| C7H16 | Heptan | -91 | 98 | C22H46 | Dokosan | 42 | 370 |
| C8H18 | Oktan | -57 | 126 | C23H48 | Trikosan | 49 | 380 |
| C9H20 | Nonan | -51 | 151 | C24H50 | Tetrakosan | 52 | 391 |
| C10H22 | Dekan | -30 | 174 | C25H52 | Pentakosan | 54 | 402 |
| C11H24 | Undekan | -26 | 195 | C26H54 | Hexakosan | 56,4 | 412 |
| C12H26 | Dodekan | -12 | 215 | C27H56 | Heptakosan | 59,5 | 442 |
| C13H28 | Tridekan | -5 | 234 | C28H58 | Octakosan | 64,5 | 432 |
| C14H30 | Tetradekan | 5,5 | 253 | C29H60 | Nonakosan | 63,7 | 440 |
| C15H32 | Pentadekan | 9,9 | 270 | C30H62 | Triakontan | 65,8 | 450 |

Was macht die Alkane so besonders?
- Die von Methan abgeleiteten Verbindungen werden als Alkane bezeichnet.
- Alkane kommen als unverzweigte Ketten, verzweigte Alkane oder als cyclischen Alkane vor.
- Alkane mit der gleichen Summenformel, aber verschiedener Strukturformel nennt man Isomere (so gibt es zwei C4H10 Moleküle, drei C5H12 Moleküle und 4,111,846,763 mögliche C30H62 Isomere ;-) ).
- In Alkanen bilden Kohlenstoffe 4 Einfachbindungen aus, Wasserstoffe bilden immer nur eine!
- Die Alkane C1 bis C4 sind bei Raumtemperatur gasförmig. Ab C14H30 sind Alkane bei Raumtemperatur Feststoffe.
- Bei Raumtemperatur flüssige Alkane sind wasserklare Flüssigkeiten mit stark aromatischem Geruch, der an Benzin erinnert. Je länger die Kohlenstoffkette wird, desto dickflüssiger, öliger werden sie. Der Geruch lässt entsprechend nach.
- Alkane könne auch in Ringen auftreten. Man nennt sie dann Cycloalkane.
- Alkane werden auch wegen der Abwesenheit von Doppelbindungen als gesättigt bezeichnet.
- Rein kettenförmige Alkane werden auch als n-Alkane (z.B. n-Heptan) bezeichnet. Verzweigte Alkane werden als iso-Alkane bezeichnet.
- Je länger die Kohlenstoffkette (also mit zunehmender Molekülmasse), desto höher liegen Schmelz- und Siedepunkte des Alkans. Ursache sind steigenden van der Waals-Kräfte aufgrund zunehmender Kettenlänge.
Allgemeine Formel der zyklischen Alkane: Cn H2n
Lange unverzweigte Alkane bilden lineare Zick-Zack-Ketten aus.Alkangemische
a) Paraffin
Ein Gemisch langkettiger (C18-C45) Alkane wird als Paraffin bezeichnet. Eine allgemeine Summenformel kann somit nicht angegeben werden. Die molare Masse liegt damit zwischen 275-600 g/ mol.
Es ist weiß, mit einer leichten Transparenz. Es entsteht z.B. als Produkt der Erdöldestillation. Paraffin ist geruchlos. Hartparaffin schmilzt zwischen 50 und 60 °C, Weichparaffin bei etwa 45 °C.
- Verwendung von Paraffin
- als Kerzenwachs
- Mikrowachs
- Ceresin
- Lackpoliturzusatz
- Petroleumersatz (Brennstoff für Öllampen)
- Vaseline
- Ausgangsstoff bei der Herstellung von Kaugummi
b) Benzin
Benzin ist eine Mischung aus verschiedenen leichten Kohlenwasserstoffen. Es befinden sich neben Alkanen auch Cycloalkane, Alkene (mit Doppelbindungen) und Alkine (mit Dreifachbindungen) im Gemisch. Benzin wird durch fraktionierte Destillation aus Erdöl oder auch im geringen Maße durch Kohleverflüssigung gewonnen.
Zusatzinformationen Paraffin Benzin
Isomerie
In Campinggaskartuschen findet man in der Regel das Gas Butan, da es einen Siedepunkt von ca. 0,5°C hat, lässt es sich unter etwas Druck leicht verflüssigen. Das komprimierte Gas wird dadurch flüssig, obwohl in solchen Campinggaskartuschen nicht allzu starker Druck vorliegt.
Untersucht man das enthaltene Gas genau, so findet man meist zwei verschiedene Gase, welche allerdings eine identische Anzahl an Kohlenstoff und Wasserstoffatomen haben.
-
n-Butan, Smp.: -139 °C, Sdp.: -0,6 °C
-
iso-Butan, Smp.: -160 °C, Sdp.: -12 °C
Von Butan existieren zwei Formen, diese werden Isomere genannt. Beide sind gasförmige, farblose, gesättigte Kohlenwasserstoffe. Sie unterscheiden sich jedoch hinsichtlich ihrer Eigenschaften. Vor allem Schmelz- und Siedepunkte sowie die Dichte unterscheiden sich deutlich. In anderen Eigenschaften sind sie sich ähnlicher.
Die Ursache für die höheren Schmelz- und Siedepunkte des n-Butans liegen in der besser Ausbildung von Van der Waals-Kräften. Diese bilden sich im allgemeinen bei kettenförmigen Molekülen immer besser aus. Dadurch halten die Ketten besser „zusammen“ und man benötigt mehr Energie (in diesem Fall Temperatur) um die Moleküle so stark ins schwingen zu versetzen, dass sie den Aggregatzustand ändern.
Moleküle mit verzweigten Ketten haben immer geringere Siedepunkte als unverzweigte, weil die Van der Waals-Kräfte sich zwischen Ketten besser ausbilden als bei ungleichmäßig geformten Molekülen.
Aufgabe:
- Zeichne alle Isomere von Pentan, Hexan, Heptan usw.
Die Isomerenanzahl wächst sehr rasch mit steigender Kohlenstoffzahl.
- C7H16: 9 Isomere
- C8H18: 18 Isomere
- C10H22: 75 Isomere
- C15H32: 4347 Isomere
- C20H42: 366319 Isomere
- C30H62: 4,111,846,763 Isomere
Die Zahl der tatsächlich existierenden Isomere ist kleiner, als die Zahl der theoretisch möglichen!
Stoffvielfalt durch Isomerie
| Butan | Pentan | Hexan | Octan |
|---|---|---|---|
| 2 Isomere | 3 Isomere | 5 Isomere | 17 Isomere |
Smp: -138,3°C Sdp: -0,5°C |
Smp: -130°C Sdp: 36°C |
Smp: -56,8 Sdp: 125,7 | |
 Smp: -159,4v°C Sdp: -11,7°C |
-159°C 28°C |
Zusatzinformationen Isomerie
Isomere von Heptan und Oktan
- http://www.guidobauersachs.de/oc/heptanisomere.gif
- http://www.guidobauersachs.de/oc/oktanisomere.gif
Konformations-Isomerie am Beispiel des Ethans
- H3C―CH3
Kohlenstoff ist sp³-hybridisiert und die C-C-Bindung frei drehbar.
Zwei Möglichkeiten der Darstellung:

| ekliptische (verdeckte) Konformation | gestaffelte Konformation | |
|---|---|---|
| Newman-Projektion |  | |
| Kugel-Stab-Modell |  | |
Einfache Reaktionen der Alkane
- Alkane sind gut brennbar. Alkane dienen z.B. als Energieträger für Verbrennungsmotoren (Diesel, Benzin, Kerosin) sowie zum Heizen von Häusern. Dabei gilt folgende allgemeine Reaktionsgleichung → es entstehen immer Wasser und Kohlenstoffdioxid:
- CnH2n+2 + (2n +1) O2 → n CO2 + (n+1) H2O + E
- Je länger die Kette, desto gelber die Flamme (und desto höher die Leuchtkraft), weil mehr Ruß durch unvollständige Verbrennung entsteht.
- Alkane brennen erst oberhalb der Verdampfungstemperatur, da zum Brennen ein Alkangas-Luftgemisch notwendig ist.
- Innerhalb der Explosionsgrenze explodieren Alkane. Die Explosionsgrenze ist bei Alkanen nicht einheitlich!

- Eine typische Reaktion ist die Halogenierung von Alkanen durch radikalische Substitution (z.B.: Brom wird zu n-Hexan gegeben). Anschließend wird mit Sonnenlicht oder dem Overhead-Projektor belichtet. Der Nachweis findet durch Universalindikatorpapier (über dem RG) statt.
Vorkommen und wichtige Beispiele der Alkane
1. Methan
- Vorkommen
- Hauptbestandteil von Erdgas. Auch in aus Steinkohle gebildetem Stadtgas enthalten. Dazu findet eine trockene Destillation von Steinkohle unter Luftausschluss bei 1200 °C statt. Der Rest wird als Koks bezeichnet.
- Methan entsteht in der Natur bei: - Fäulnisprozessen (z.B. im Komposthaufen, in Sümpfen und im Klärschlamm der Kläranlage- der Cellulosegärung der Wiederkäuer- unterirdisch in Steinkohlegruben als Grubengas (Gefahr, da die „schlagenden Wetter“ (Methan-Luft-Explosionen) die durch einen Funken entstehen können.
- Es entsteht bei Vedauungsvorgängen von Wiederkäuern sowie beim Reisanbau (Anteil des Reisanbaus an der weltweiten Methanproduktion ca. 17 %!).
- Eigenschaften und Verwendung
- farb- und geruchloses Gas (Wieso heißt es eigentlich in Krimis immer: „Es riecht nach Gas.“? Weil es einen Zusatzstoff enthält der den typischen Geruch auslöst um Gas erkennbar zu machen!)
- Methan ist in Wasser unlöslich
- brennbar: CH4 + 2 O2 → CO2 + 2 H2OH = -888 kJ/mol
- geringere Dichte als Luft
- explosives Luft/Methan-Gemisch(Explosionsgrenze 10% - 90% CH4)
- wichtigen Rohstoff der chemischen Industrie. So wird Beispielsweise Wasserstoff durch thermische Spaltung oder durch Reaktionen mit Wasserdampf (an Nickel-Katalysatoren) gewonnen, durch Hitzespaltung gewinnt man Acetylen (Ethin) C2H2:
- CH4 + E → C + 2H2 (bei 1200°C)
- CH4 + H2O → CO + 3H2 (bei 800-900°C, an einem Nickelkatalysator)
- 2 CH4 → C2H2 + 3H2
Zusatzinformationen: Methan
2. Propan:
- Tritt als Begleiter des Erdöls, im Erdgas und in Crackgasen auf.
- Wird als Stadtgas zum Beheizen von Häusern verwendet.
- Treibgas in Sprays
Zusatzinformationen: Propan
3. Butan und sein Isomer:
- n-Butan und Isobutan sind Flüssiggase, die bei der Erdöldestillation anfallen. Sie kommen im Erdöl und Erdgas vor.
- in Wasser ist Butan so gut wie unlöslich (nur 150 ml/l).
- Beide Isomere verhalten sich chemisch ähnlich (beide sind brennbar und werden von den Halogenen Chlor und Brom unter Lichteinfluss angegriffen.
- n-Butan wird seit dem FCKW-Verbot als Treibgas in Spraydosen verwendet.
- Beide Isomere werden in Feuerzeugen, oft im Gemisch mit Propan, eingesetzt.
- Butan wird (trotz der Brennbarkeit) im Kühlschrank als Kältemittel eingesetzt
- manche Solarkollektoren verwenden Isobutan als Wärme(über)träger.
Zusatzinformationen: Butan
4. Pentan und seine Isomere:
- Es gibt drei Isomere des Pentans.
- Der Flammpunkt liegt bei -49 °C, die Zündtemperatur bei 309 °C.
- Löslichkeit: 0.36 g/l (16 °C) in Wasser.
- Pentan wird heutzutage als FCKW-freies Kältemittel in Kühlschränken und Klimaanlagen verwendet.
Zusatzinformationen:
Cycloalkane
Du kennst jetzt die kettenförmigen Alkane, man nennt sie auch aliphatische Alkane. Ihre Kette kann verzweigt oder unverzweigt sein. Wenn Kohlenstoffatome sich in einem Ring anordnen, nennt man diese auch Cycloalkane.
Die Eigenschaften der Cycloalkane sind mehr oder weniger die typischen physikalischen und chemischen Eigenschaften der Alkane. In der Natur spielen zyklische Ringsysteme als Bestandteile vieler pflanzlicher und tierischer Stoffe eine große Rolle. Allerdings liegen dort oft Cycloalkane mit mehreren Mehrfachbindungen vor. Diese haben dann deutlich andere Eigenschaften als die Alkane.

Cyclopropan ist ein brennbares Gas mit einem Sdp. von -33°C, es ist reaktionsfreudig, da die Bindungswinkel zwischen den einzelnen Kohlenstoffatomen stark vom üblichen Tetraederwinkel abweichen und somit die Ringe unter einer gewissen inneren Spannung stehen. Durch eine Reaktion kann der Ring aufgebrochen werden, was viel Energie freisetzt.
Cyclobutan ist ebenfalls ein brennbares Gas. Sein Sdp. liegt bei 12,5°C. Es ist aus den gleichen Gründen ebenfalls reaktionsfreudig.
Cyclopentan ist eine farblose Flüssigkeit, die leicht entzündbar ist. Der Sdp. liegt bei 49°C.
Cyclohexan ist ebenfalls eine farblose Flüssigkeit. Sein Sdp. liegt bei 81°C. Es ist nicht so reaktionsfreudig, da hier ein sehr „entspannter“ Tetraederwinkel vorliegt. Obwohl der Ring planar gezeichnet ist, so ist er es nicht!
| Name | Summenformel | Sdp. | Ringspannung | Strukturformel |
|---|---|---|---|---|
| Cyclopropan | C3H6 | -33°C | 115 | 
|
| Cyclobutan | C4H8 | -12°C | 110 | 
|
| Cyclopentan | C5H10 | 59°C | 27 | 
|
| Cyclohexan | C6H12 | 81°C | 0 | 
|
Zusatzinformationen: Cycloalkane
Stabilität der cyclischen Alkane
Allgemeine Formel der cyklischen Alkane: CnH2n
- Homologe Reihe
- Cyclopropan (C3H6): sehr instabil
- Cyclobutan (C4H8): stabil
- Cyclopentan (C5H10): stabil
- Cyclohexan (C6H12): stabil
- Cycloheptan (C7H14): instabil
- Cyclooctan (C8H16): stabil
Alkene und Alkine

Ethen (Trivialname Ethylen) ist ein farbloses, süßlich riechendes Gas. Es ist das einfachste Alken und enthält eine Doppelbindung. Man spricht auch von einem ungesättigten Kohlenwasserstoff.
Wenn man den räumlichen Bau anschaut, sieht man schnell, dass es ein planares Molekül ist, welches einen Bindungswinkel von 120° hat.

Ethen wird als Pflanzenhormon verwendet. So werden z.B. noch grüne Bananen gepflückt, transportiert und dann kurz vor Verkauf mit Ethen begast, welches sie zum Reifen bringt.
Auch reife Früchte wie Bananen geben Ethen ab, so dass unreifes Obst, wie Tomaten, in Gegenwart von Bananen weiter reifen.
Des weiteren ist es Ausgangsstoff für sehr viele chemische Synthesen und zur Kunststoffherstellung (PE - Polyethylen, Polystyrol (=Styropor) sowie Polyester u.a.). Auch der Alkohol Ethanol kann daraus hergestellt werden.
Vorsicht: Ethen ist hochentzündlich. Bei einem Luftvolumenanteil von 3 - 36% bildet es explosive Gemische. In hoher Konzentration wirkt es auch als Betäubungsmittel.

Ethin:Ethin (Trivialname Acetylen) ist ebenfalls ein farbloses, leicht süßlich riechendes Gas. Beide Kohlenstoffatome sind über eine Dreifachbindung miteinander verbunden. Es ist der einfachste Vertreter aus der homologen Reihe der Alkine:
Der räumlichen Bau ist planar (kettenförmig) (Bindungswinkel von 180°).
Es brennt mit stark rußender Flamme. Im richtigen Gemisch mit Sauerstoff werden dabei Temperaturen von bis zu 3100°C erreicht. Aus diesem Grunde wird es als Schweißgas verwendet.
Ethin-Luftgemische zwischen 2-82% Luftvolumenanteil sind hochexplosiv. Unter hohem Druck zerfällt es, so dass es in Schweißflaschen nur mit geringem Druck gelagert werden kann.
Die Löslichkeit in Wasser beträgt Normalbedingungen nur 1,23 g/l, wohingegen die Löslichkeit in Alkohol und Aceton sehr gut ist.
Außer zum Schweißen ist dieses Gas besonders gut für chemische Synthesen als Ausgangsstoff geeignet. Außer Kunststoffen wie Polyvinylchlorid[2] (PVC) werden auch viele organische Säuren wie Essigsäure daraus hergestellt.
Zusatzinformationen
Die Genfer Nomenklatur von organischen Verbindungen (IUPAC) - Teil 1
- Es wird die längste Kohlenstoffkette gesucht und die Kohlenstoffatome werden entsprechend nummeriert. Dabei spielt es keine Rolle, ob von Links oder rechts gelesen wird!
- Bei Doppelbindungen wird die Endsilbe „-an“ durch die Silbe „-en“ ersetzt. Die Endung „-in“ wird für Dreifachbindungen verwendet. Die Kette wird dann so nummeriert, dass die Doppel- (bzw. Dreifach-) Bindung die niedrigste Ziffer erhält. Die Lage der Mehrfachbindungen im Molekül wird durch die Nummer des Kohlenstoffatoms bezeichnet, das in der Mehrfachbindung die kleinere Nummer trägt. Sie wird vor (oder früher auch nach) dem Namen des Alkens stehen. Treten mehrere Mehrfachbindungen auf, wird ein „di, tri... “ vor die Endsilbe eingesetzt.
Propen
(1,5)-Heptdien - Seitengruppen werden mit den Namen der entsprechenden Alkane (Alkene/ Alkine) und der Endung „-yl“ gekennzeichnet. Ihre Anzahl wird, (wenn von 1 abweichend) durch die Silben Di-, Tri-, Tetra-, Penta- gekennzeichnet: Vor die Bezeichnung des Restes kommt die Nummer der Stelle der Verzweigung. Treten z.B. zwei Methyl Reste auf, so kommt noch die Silbe „di“ hinzu. Die Seitengruppen werden in alphabetischer Reihenfolge genannt (also -ethyl vor -methyl).
→ 3-Ethyl, 4-Methyl-Heptan → 3, 3-Dimethyl-1-Hepten - Mehrere Doppelbindungen werden durch die Endsilbe „-dien“ gekennzeichnet. Verbindungen mit Doppel- und Dreifachbindungen werden durch die Endungen „-enin“ gekennzeichnet. Sind viele Mehrfachbindungen (oder funktionelle Gruppen) vorhanden, kann die Zahl auch direkt vor das -en oder -in gestellt werden: z.B. 1-Buten = But-1-en.
→ 3-Ethyl, 4-Methyl-(1,5)-Heptdien → 5 Ethyl, 2,5-Dimethyl-(1,6)-Heptenin - Wichtig: Die Nummerierung der Kohlenstoffkette (siehe 1.) ist so durchzuführen, dass nicht nur Mehrfachbindungen, sondern auch Seitenketten eine möglichst niedrige Nummer erhalten.
Zusatzinformationen:
Übungen zur Nomenklatur organischer Verbindungen (Domino)
Im Benzin enthaltene Alkane und Alkine
Benzin ist ein Gemisch. Es enthält mehrere verschiedene Alkane, Cykloalkane, Alkene und Cycloalkene. Hier ein Ausschnitt eines typischen Benzins:
- Aufgaben
- Ordne die folgenden Namen den einzelnen Verbindungen zu:
1,3 Diethyl-Cyclo-Pentan, 2,4,5 Trimethyl-Heptan, 1,2 Dimethyl-Cyclohexan, 3,4, Dimethyl-Octan, 3 Isopropyl-Hexan, Oktan, Benzol (=1,3,5-Hextrien), Heptan, 2,2,4 Trimethyl-Heptan, 1,3,5 Trimethyl-Benzol, 3 Methyl-Pentan, Isopropyl-4-Propyl-Benzol, 4 Ethyl-3 Methyl-Heptan, 3,4 Dimethyl-Heptan, (1-Methyl-Propyl)-Cyclopentan, Isobutyl-Benzol. - Wie kann man die unterschiedliche Zusammensetzung des Gemisches „Benzin“ erklären?
Bindungswinkel und Drehbarkeit
a) Alkane
Erinnere Dich an das Kapitel „Atombindung“. Nach der Elektronenpaarabstoßungstheorie stoßen sich Elektronen voneinander ab. Deshalb haben auch Bindungselektronenpaare immer einen größtmöglichen Abstand voneinander. Ein Atom mit vier Bindungen (also genauso wie der Kohlenstoff in Methan, Ethan usw.) liegt also nicht so vor, wie wir ihn oft zeichen:
-
Einfache Darstellung, welche oft ausreicht - aber nicht exakt ist!
-
Der Bindungswinkel ist tatsächlich aber nicht 90°C. → Ein größerer Winkel ist möglich!
Maximale Abstoßung liegt bei einem Winkel von 109,5° vor. Die räumliche Gestalt, welche entsteht, wenn man die H's verbindet, nennt man Tetraeder.
Dies ist die räumliche Anordnung, wie sie bei sehr vielen Molekülen, welche 4 Bindungspartner haben vorliegt, ermöglicht den größtmöglichen Abstand zwischen den Bindungspartnern.
Hintergrund ist die Abstoßung der Elektronenwolken untereinander (und im Übrigen auch die der Atomkerne). Elektronen und Atome „versuchen“ jeweils einen möglichst großen Abstand voneinander zu bekommen.
b) Alkene

In Alkenen liegen am Doppelbindungs-“C“ nur 3 Bindungen vor (die Doppelbindung zählt nur einmal, da sie ja nur EINE Doppelbindung ist!). Der Bindungswinkel beträgt 120°.
Die Doppelbindung ist nicht frei drehbar!
b) Alkine

Ein C mit Dreifachbindung hat nur 2 Bindungen. Somit ist der maximale Abstand erreicht, wenn ein Bindungswinkel von 180° vorliegt!
Die Dreifachbindung ist nicht drehbar!
Funktionelle Gruppen
- Alle Seitenketten oder besonderen Substituenten (das sind Atome, welche H in der Kohlenstoffkette ersetzen) werden funktionelle Gruppen genannt. Auch Seitenketten (mit oder ohne Doppelbindung) gelten als funktionelle Gruppen.
- Sind andere Atome als C oder H in funktionellen Gruppen beteiligt, führen diese in der Regel zu polaren Atombindungen und somit oft zu Dipolen. Dies hat wiederum Einfluss auf Siede- und Schmelzpunkte sowie die Löslichkeit in polaren Lösungsmitteln. Es gilt, je stärker der Dipol, desto eher löst sich der Stoff auch in Wasser.
- Funktionelle Gruppen sind leichter angreifbar als die Hauptkette. Hier finden also oft die Reaktionen statt.
- Hat man als funktionelle Gruppen neben den Alkylresten auch Halogene oder Sauerstoff, Stickstoff oder Mehrfachbindungen, so werden diese (wenn man es sehr genau mit der Nomenklatur nimmt) in folgender Reihenfolge benannt:Brom vor Chlor vor Sauerstoff vor Stickstoff vor Doppelbindungen vor Alkylketten
- Hintergrund dieser Anordnung ist die Massenzahl: 35Br > 17Cl > 8O > 7N > 6C)
- Seitenketten mit Einfachbindungen enden auf -yl (Methyl, Ethyl usw.), Seitenketen mit Doppelbindungen enden auf -enyl (Ethenyl, Propenyl usw.).
- Alternativ zum cis/trans-Bennenungssystem wurde ein weiteres, das E/Z-System eingeführt (siehe Wikipedia unter Nomenklatur!)
- Auch Mehrfachbindungen zwischen zwei Kohlenstoffen der Hauptkette gelten als funktionelle Gruppe. Sie werden oft bei Reaktionen aufgespalten! → Moleküle mit Mehrfachbindungen sind deutlich reaktiver als reine Alkane!
- Die funktionelle Gruppe eines aromatischen Benzolringes wird als „Phenyl“ bezeichnet, also die Atomgruppe –C6H5.
Verschiedene graphische Darstellungsmöglichkeiten von organischen Verbindungen
Organische Verbindungen sind im Aufbau komplex. Durch ihre dreidimensionalen Aufbau ist es schwierig, sie zweidimensional auf Papier darzustellen. Hier eine Übersicht über verschiedene Darstellungsweisen:
- a) Summenformel
Die Summenformel beschreibt einfach die Summe der beteiligten Atome. Sie sagt nichts über den tatsächlichen Aufbau aus.
C2H6 - Ethan
- b) Konstitutionsformel
Die Konstitutionsformel zeigt den einfachen, zweidimensionalen Aufbau der Verknüpfungen von Kohlenwasserstoffen.
- c) Strukturformel
In der Regel entspricht sie der Konstitutionsformel. Sie kann (bei einfachen Molekülen) auch dreidimensional gezeichnet sein (gestrichelte Linien ragen nach hinten, dicke Dreieckslinien ragen nach vorn - aus der Ebene hinaus).
- d) Halbstrukturformel (Kettenschreibweise)
- Propan: CH3-CH2-CH3
- Iso-Butan: CH3-CH(CH3)-CH3
- e) Strichschreibweise
Bei dieser Schreibweise werden Wasserstoffe nicht gezeichnet. Die Kohlenstoffatome befinden sich an den Winkeln bzw. Schnittpunkten.
- Weitere Möglichkeiten der dreidimensionalen Abbildung für die K12
Wiederholungsaufgaben
- Was versteht man unter einer Atombindung? Zeichne die Atombindung zwei Sauerstoffatome.
- Zeichne die folgenden Verbindungen als Valenzstrichformel: H2, O2, N2, Cl2, HCl, CO, H2O, CH4, CO2
- Was ist die homologe Reihe der Alkane? Wie unterscheiden sich Alkane, Alkene und Alkine? Nenne je ein Beispiel sowie die allgemeine Formel.
- Welchen Zusammenhang siehst du zwischen der Länge der Kohlenstoffkette und dem Litergewicht sowie der Siedetemperatur der homologen Reihe der Alkane?
- a) Welche Summenformel haben Cyclo-Alkane b) Alkene mit zwei Doppelbindungen)?
- Erkläre den Begriff „Isomer“. Zeichne dann alle Isomere von Hexan.
- Wie erklärst Du Dir die Vielfalt der organischen Verbindungen?
- Nenne 10 Stoffe in denen Kohlenstoff enthalten ist
- Wie kann man Kohlenstoff chemisch nachweisen? Beschreibe ein Experiment mit Aufbau.
- Welche Gefahr geht von den Dämpfen kohlenstoffhaltiger Lösungsmittel (z.B. Benzin oder Alkohol) aus?
- Kohlenstoff steht in der 4. HG. Wie viel Atombindungen kann ein Element der 4. HG nur haben?
- Stelle die Valenzstrichformeln der folgenden Verbindungen auf: a) alle Dir bekannten Säurenb) Methan, Heptan, C2H6, C6H14, C4H10, C9H20, C2H4, C6H12, C6H6
- Wiederhole die Regeln der Genfer Nomenklatur.
- Zeichne: 2,2 Dimethyl Propan; 2,3,4 Trimethyl-Penten; 4,4, Dimethyl Heptan
- Unter welchen Bedingungen konnten sich Erdgas und Erdöl bilden. Beschreibe den Vorgang.
- Norddeutsches Erdgas enthält auch Schwefelwasserstoff. Welche Gefahren würden auftreten, wenn dieser Bestandteil nicht vor der Verbrennung heraus gewaschen würde? Begründe mit einer Reaktionsgleichung!
- Woran liegt es, dass die Zusammensetzung des Erdöls aus verschiedenen Ländern unterschiedlich ist?
- Erkläre den Begriff „Isomer“ und stelle alle Isomere von Hexan auf
- Gib die Strukturformeln und Namen von 4 isomeren Alkoholen der Summenformel C4H11OH an!
- Zeichne die folgenden Strukturformeln und benenne die Substanzen:a) CH3-CHCl2 b) C2H5OH c) CH3-CH4O d) C2H3Br e) C3H8Cl f) C6H6 g) C3H8 h) C3H5Cl i) C3H4COOH j) C3H3O k) Butanal l) (CH3)3CCH3 m) CH2=C(CH3)CH2F n) H3C-CH2-Br o) 1,5-Diiodpenta-1,4-dien p) 2-Fluor-3,4-dimethylhex-3-en q) 4,4, Dimethyl Heptan r) 2,3,4 Trimethyl Penten s) H3C-CH2-CH2-CH2-CH2 t) H3C-CH=CH-CH=CH-CH3 u) 2,2 Dimethyl Propan
- Begründe, warum es in der organischen Chemie eine theoretisch unendliche Anzahl an Verbindungen gibt.
- Warum ist Kohlenstoff immer vierbindig und warum darf Wasserstoff nur eine Bindung haben? Wie viele Bindungen hat Stickstoff? Wie sehen die typisch gebunden Sauerstoffe aus?
- Nenne 10 Stoffe in denen Kohlenstoff enthalten ist. Wie kann man Kohlenstoff in ihnen chemisch nachweisen? Beschreibe ein Experiment. (Wie kann man Halogene in Kohlenwasserstoffen nachweisen?)
- Vervollständige die Tabelle:
| Stoffklasse | funktionelle Gruppe | Endung | Beispiel |
|---|---|---|---|
| Alkan | C-C | ||
| Alken | |||
| Alkin | |||
| Alkohol | |||
| Carbonsäure | |||
| Halogenalkane |
- Erstelle eine Übersicht über die drei Dir nun bekannten Reaktionsmechanismen. Erkläre jeden Mechanismus schrittgenau. und nenne jeweils mögliche Ausgangstoffe (=Edukte) und mögliche Produkte.
- Benenne die folgenden Verbindungen:
Eigenschaften und Reaktionen von Kohlenwasserstoffen
Viskosität
In diesem Kapitel lernst Du einiges zu Eigenschaften und Verwendung von Alkanen. Zuerst soll eine besondere Eigenschaft von Flüssigkeiten untersucht werden.
Dazu werden in einem Experiment 5 Flüssigkeiten nach der Fallgeschwindigkeit einer Metallkugel untersucht. Eine Reihenfolge der Geschwindigkeit soll bestimmt werden.
- Benzin > Wasser > Diesel > Pflanzenöl > Paraffin
- C8H18 > H2O > z.B.: C14H30 > z.B.: C30H62 > z.B.: C22H46
Wie kann man aber unterschiedlichen Messergebnisse erklären?
- Informationen zur Viskosität
- Der Begriff „Viskosität“ hat seinen Ursprung im lateinischen Wort für Mistel „viscum“, da früher aus ihren Beeren zäher Vogelleim hergestellt wurde
- Physiker unterschieden zwischen Newton'schen Flüssigkeit und nicht-Newtonsche Flüssigkeiten, wie Margarine oder Vanilleeis.
- Bei Alkanen hat Nonan eine Viskosität ähnlich der von Wasser
- ihre Maßeinheit ist N · s / m2 (mPa/ s)
- Der Fall der Kugel ist abhängig von der nach oben gerichtete Auftriebskraft FA, der nach unten gerichtete Gewichtskraft FG, der nach oben gerichtet Reibungskraft FR
- Paraffin wird als Schmiermittel z.B. in Waffenöl und Vaseline benutzt
Vergleich von Viskositäten verschiedener Flüssigkeiten
| Flüssigkeit | Viskosität [N·s/ m2] |
|---|---|
| Pentan | 0,23 |
| Hexan | 0,32 |
| Heptan | 0,41 |
| Oktan | 0,54 |
| Nonan | 0,71 |
| Dekan | 0,92 |
| Petroleum | 0,65 |
| Wasser | 1,00 |
| Ethanol | 1,19 |
| Quecksilber | 1,50 |
| Traubensaft | 2-5 |
| Blut (37°C) | 4-25 |
| Kaffeesahne | ca. 10 |
| Olivenöl | ca. 102 |
| Honig | ca. 104 |
| Paraffinöl | 110 - 230 |
| Bitumen | ca. 1010 |
| Glycerin | 1480 |
| Asphalt | 100000 |
Was sind die molekularen Ursachen der verschiedenen Viskositäten?
Beim Fallen einer Kugel durch verschiedene Flüssigkeiten sieht man deutlich eine Zunahme der Viskosität bei langkettigen Molekülen.
→ Langkettige Moleküle haften scheinbar besser zusammen, so dass eine fallende Kugel einen größeren Widerstand beim Fallen hat.
a) Idealfall - völlig symmetrische Verteilung der Elektronen (Bsp.: C3H6)
b) Normalfall - asymmetrische Verteilung der Elektronen → kurzzeitige Dipole bilden sich, es kommt zur zwischenmolekularen Anziehung!
Elektronen bewegen sich zwischen den Atomen, was zu einer momentanen, ungleichmäßigen Ladungsverteilung im Molekül führt. Es bilden sich temporärere Dipole. Man spricht auch von asymmetrischen Ladungsverteilungen. Als Folge kommt es zu Wechselwirkungen mit anderen Molekülen, das heißt der Pluspol eines Dipols induziert beim Nachbarmolekül einen Minuspol. So entsteht dort ein induzierter Dipol.
Der Einfluss der VdW-Kräfte ist durch eine einfache Modellvorstellung leicht zu erkennen:
Die Metallkugel muss bei kurzkettigen Alkanen viel weniger Bindungen aufspalten, sie fällt schneller → die Flüssigkeit hat eine geringere Viskosität
- Aufgaben
- Warum spricht man bei Viskosität auch von der „inneren Reibung“?
- Nenne hoch viskose Flüssigkeiten des Alltags.
- Stelle einen Viskositätenvergleich bei isomeren Alkanen an (z.B. n-Pentan & iso-Pentan).
- Aceton hat eine Viskosität von nur 0,33. Kannst Du Ursachen erkennen, die mit seinem Aufbau zu tun haben?
- Erkläre mit Hilfe von Zeichnungen Van der Waals-Kräfte und ihre Wirkung besonders auf Flüssigkeiten langkettiger Kohlenwasserstoffe.
- Wiederhole die Einflussfaktoren auf die Viskosität einer Flüssigkeit.
Zusatzinformationen zu Van der Waals-Kräften
- Benannt nach dem Physiker Johannes Diderik van der Waals
- im Vergleich zur Atombindung und Ionenbindung sind sie nur eine schwache Bindungskraft
- sie treten immer auf (!), man bemerkt sie aber meist nur in Flüssigkeiten, die keine Ionenbindungen haben
- Das Zustandekommen von Van-der-Waals-Bindung ist sehr vom Abstand der Moleküle abhängig. Zwei Atome beziehungsweise Moleküle müssen sich also sehr nahe kommen, bevor es zu einer Wechselwirkung kommt.
- Diese Annäherung ist umso schwieriger, je verzweigter die Moleküle sind und je stärker sie sich bewegen. Mit anderen nimmt die Viskosität ab, je höher die Temperatur ist, also je mehr kinetische Energie die Moleküle haben. Mit steigender Temperatur reißen Van-der-Waals-Bindungen auf. Dies ist bei nicht ionogenen Flüssigkeiten in der Regel der Übergang vom flüssigen zum gasförmigen Zustand.

- Anschauliche Auswirkung der Van-der-Waals-Kräfte - Geckos (Reptilien), nutzen die Van-der-Waals-Kräfte, um an senkrechte Flächen zu klettern. Sie haben dazu Haftballen unter ihren Füßen mit sehr vielen feinen Härchen. Durch jedes kleine Härchen kommt es ein wenig zur Anziehung mit, also zur Wechselwirkung mit der glatten Oberfläche. Durch die hohe Anzahl der Härchen, reicht diese Kraft aus, Geckos sogar kopfüber unter Glas laufen zu lassen.
- Das längste Experiment: Der Physiker der Universität Queensland in Brisbane, Australien Thomas Parnell (1881-1948), startete 1930 ein Experiment mit dem „Feststoff“ Pech (Rückstand bei der Teerdestillation), welches sogar mit einem Hammer zertrümmert werden kann. Vor 70 Jahren füllte er einen Trichter mit Pech. Er wollte zeigen, dass es bei Raumtemperatur eigentlich (sehr!) zähflüssig ist. (Ca. 100 000 000 000 viskoser als Wasser). Schon 1938 tropfte der erste Tropfen aus dem Trichter. (1947, 1954, 1962, 1970, 1979, 1988 und 2000 weitere. Für ca. 2012 wird der nächste erwartet.
Löslichkeit
Aus dem ersten und dem dritten Jahr Chemieunterricht kennst Du schon ein paar Eigenschaften von Flüssigkeiten. Dazu gehört auch die Löslichkeit. Während Du damals die Löslichkeit von Feststoffen, wie Salzen in Wasser untersucht hast, wirst Du diesmal etwas über die Löslichkeit von Kohlenwasserstoffen wie Alkanen lernen.
V: Mische Fett und Wasser im RG. Anstelle des Fetts können auch Flüssigkeiten wie Öl, Benzin, Paraffin untersucht werden. Teste auch die Löslichkeit der Stoffe untereinander.
B: Bei vielen Flüssigkeitsgemischen sieht man deutlich 2 Phasen im RG. Ein Einfärben der wässrigen (zur Identifizierung) mit KMnO4 oder Tinte ist leicht möglich.
S: Alle flüssigen Alkane sind (wie sehr viele organische Lösungsmittel) unpolar, also Wasser abstoßend (=hydrophob). Mischt man Alkane mit Wasser, ergibt sich für einen kurzen Zeitraum eine „Emulsion“ - nach wenigen Sekunden entmischt sich aber alles in zwei Phasen. Die Alkane schwimmen dabei immer oben, da sie in der Regel eine geringere Dichte als Wasser haben.
Gründe für den apolaren Charakter der Alkane
Die C-H Bindung der Alkane ist durch die geringe Differenz der Elektronegativitäten nur gering Polar. Zusätzlich fallen die ohnehin schwachen Partialladungen durch den symmetrischen Bau des Alkans in einem Punkt zusammen.
→ das Dipolmoment aller gesättigter Kohlenwasserstoffe ist somit immer null!
→ Alkane sind unpolar (hydrophob (=wasserfeindlich) und gleichzeitig lipophil (=fettliebend))
→ sie lösen sich nur in unpolaren Lösungsmitteln und mischen sich nicht mit polaren Lösungsmitteln wie z.B. Wasser.
- Beispiele für Gemische apolarer Flüssigkeiten aus dem Alltag
- das 1:50 Zweitakter Gemisch für Mofas
- Fleckentfernung von Fett- und Schmierflecken der Fahrradkette mit Waschbenzin, usw.
Sie eignen sie sich somit gut, als Fleckentferner.
Waschbenzin und Terpentin werden aus diesem Grunde im Haushalt verwendet.
polar: Wasser liebend - hydrophil entspricht: Fett abstoßend - lipophob
apolar/ unpolar: Wasser abstoßend - hydrophob entspricht: Fett liebend - lipophil
Hydrophile Stoffe lösen sich gut in hydrophilen Lösungsmitteln, lipophile lösen sich gut in lipophilen Lösungsmitteln.
Vereinfacht kann man sagen, dass sich Stoffe, besonders gut in Lösungsmitteln ähnlichen Aufbaus auflösen (das führte zur weit verbreiteten (aber nicht ganz richtigen) Aussage: „Gleiches löst sich in Gleichem“).- Aufgaben
- Hähnchen verschmierte Finger lassen sich kaum nur mit Wasser reinigen. Warum?
- Wie kannst Du die fettigen „Hähnchen-Finger“ am Besten reinigen?
- Es gibt Folienstifte, die mit Wasser abgewaschen werden können. Andere Folienstifte hingegen sind permanent. Kannst Du etwas zu den Inhaltsstoffen dieser Stifte sagen?
- Nagellack wird mit dem fast unpolarem Aceton entfernt. Was verrät uns das über Nagellack?
- Welche Funktion hat ein Verdauungsschnaps nach fetthaltigem Essen?
- Zusatzinformationen
- Eine Emulsion ist ein fein verteiltes Gemisch zweier verschiedener, sich normalerweise nicht mischender Flüssigkeiten wie z.B. Öl und Wasser. Man findet sie dauerhaft in Speiseeis und Cremes.
- Emulsion
Flecken und ihre Entfernung
Wenn man erstmal die einfachen Regeln der Löslichkeit kennt - und weiß mit welcher Art von Stoff man es zu tun hat (besonders seine Polarität sollte man wissen!), dann weiß man oft auch, wie man z.B. Flecken aus Kleidung entfernen kann.
| Fleckbestandteil | Entfernung |
| Bier | Ein Lappen mit Waschbenzin oder Alkohol befeuchten und reiben, dann mit Waschmittellösung reinigen |
| Blut | in kaltem Wasser einweichen und dann mit etwas Waschmittelpulver und einem nassen Tuch reiben |
| Cola | Waschen mit Waschmittel |
| Farbe auf Ölbasis & Lacke | Waschbenzin, besser Terpentin, auf einen Lappen geben und immer wieder mit neuer, sauberer Stelle reiben |
| Fett- & Schmierflecken | kleinere Flecken mit Waschmittel, größere mit Spiritus, Waschbenzin |
| Kaugummi | Kleidungsstück ins Eisfach legen und später mechanisch entfernen. Evtl. mit Waschbenzin versuchen |
| Kugelschreiber | Spiritus oder Aceton auf einen Lappen und immer wieder mit neuer, sauberer Stelle reiben |
| Rotwein | erst über Nacht Salz auf den frischen Fleck streuen, dann mit Waschbenzin versuchen - später dann Waschmittellösung versuchen - viel Glück ;-) |
| Obstsaft | wie Rotwein |
| Schuhcreme | Lappen mit Waschbenzin getränkt nehmen und reiben, später mit Waschmittel reinigen. |
| Wachs | evtl. mit Waschbenzin und Lappen versuchen |
| Weißwein | sofort mit warmen Wasser auswaschen. |
Brennbarkeit der Alkane
Alkane sind brennbar. Auch viele Alkene und Alkine sind leicht entzündlich. Kürzerkettige Kohlenwasserstoffe sind in der Regel „leicht flüchtig“, ihre Dämpfe sind besonders leicht entzündlich.
Mit zunehmender Kettenlänge nimmt allerdings die Entzündungstemperatur zu.
- Alkanedämpfe entzünden sich beim
- Benzinrinnenversuch
- Zigarette Rauchen beim Tanken.
- Vorglühen des Dieselmotors
Vergleicht man die Alkane der homologen Reihe, so sieht man, dass die Flamme oranger und lichtstärker wird. Auch der Russanteil nimmt zu. Letzteres ist ein Indiz auf eine unvollständige Verbrennung. Würde sich ein höherer Sauerstoffanteil in Reaktionsnähe befinden, würden auch diese Alkane rückstandsfrei verbrennen.
Derartige Überlegungen sind bei der guten Ausnutzung von Benzin und Diesel im Verbrennungsmotor wichtig. Das Luft-Brennstoffgemisch ist bei optimaler Einstellung des Vergasers so gut, dass die innere Energie des Treibstoffes optimal genutzt wird und keine Rußpartikel als Abgase entstehen.
- Aufgaben
- Stelle die Reaktion der Verbrennung von Heptan, Oktan, Ethanol (=Spiritus: C2H5OH) und Zucker (C6H12O6) auf.
- Warum haben fossile Energieträger (wie Erdgas, Diesel, Benzin usw.) für den Menschen eine so hohe Bedeutung? Gibt es keinen Ersatz für sie?
- Erkläre die Funktionsweise des Benzinmotors. Erkläre mit Hilfe der folgenden Begriffe: Benzin-Luftgemisch, Verdichtung, Kolben, Zündkerze, Oktanzahl,
- Im Verbrennungsmotor entstehen als Nebenprodukt immer auch Stickoxide wie NO und NO2. Kannst Du erklären warum?
Halogenierung
Bromierung von Hexan (theoretischer Versuch)
V: In ein Reagenzglas oder einen Erlenmeyerkolben werden ca. wenige Milliliter eines Alkans (z.B. Pentan) gefüllt. Es werden aus einer Pipette wenige Tropfen Brom zugefügt. Der Kolben wird im dunklen Abzug beobachtet und dann mit dem Tageslichtprojektor beleuchtet.
Nach Ende der Reaktion werden die Dämpfe mit feuchtem Indikatorpapier gemessen.
Mit einem Tropfen der Flüssigkeit wird eine Beilsteinprobe durchgeführt.
B: Die Flüssigkeit wird durch das Brom leicht gelb gefärbt und entfärbt sich unter Lichteinfluss. Das Indikatorpapier färbt sich in den entstehenden Dämpfen leicht rot.
Zusatzversuche:
Der Indikatortest zeigt das Entstehen einer Säure an
Die Beilsteinprobe ist positiv → Halogene sind in der organischen Verbindung enthalten!
S: Durch Licht wird Brom in einzelne Atome gespalten. Diese Bromatome ersetzen (=substituieren) Wasserstoffatome im Alkan.
Mechanismus der radikalischen Substitution:
- Start durch homolytische Spaltung und der resultierenden Entstehung der Bromradikale
- E + Br–Br → Br• + •Br
- Das Bromradikal entreißt dem Pentan ein H-Radikal und bildet so ein Pentanradikal
- R–H + •Br → R• + HBr (weitere Pentanmoleküle reagieren)
- Das Pentanradikal spaltet weitere Brommoleküle zu weiteren Bromradikalen
- R• + Br–Br
- Das Bromradikal reagiert mit einem weiteren Pentan (siehe 2a)
- → radikalischer Kettenmechanismus bzw. radikalische Substitution
- Abbruch der Kettenreaktion
- es liegt kein Pentan oder Brom mehr vor.
- es reagieren zwei Radikale (zwei Bromradikale oder zwei Pentanradikale) miteinander. Dies ist statistisch wahrscheinlicher, je länger die Reaktion abläuft, da dann mehr Radikale in der Flüssigkeit zu finden sind.
- Aufgaben
- Erkläre, warum sich Brom in Alkanen überhaupt auflöst?
- Erstelle den Reaktionsmechanismus mit Chlor und Hexan
- Warum spricht man überhaupt von einem Reaktionsmechanismus?
- Was sind Halogenalkane, welche bekannten gibt es und wofür werden/ wurden sie eingesetzt.
- Zusatzinformationen
- Die Beilsteinprobe ist ein Halogennachweis. Dazu wird die zu analysierende Substanz auf ein ausgeglühtes Kupferblech getropft und in die Brennerflamme gehalten. Färbt sich die Flamme grün, ist dies ein Nachweis für Halogene, da Verbindungen vom Typ Cu(Halogen)2 eine grüne Flammenfarbe haben.
- Da hierbei Dioxine entstehen können sollte der Versuch im Abzug durchgeführt werden.
- http://de.wikipedia.org/wiki/Beilsteinprobe
- Zur Spaltung von Brom in Radikale ist Energie notwendig
- Zusatzinformationen
Reaktionsmechanismus Radikalische Substitution Radikalische Addition Elektrophile Substitution Elektrophile Addition Eliminierung Nukleophile Substitution Nukleophile Addition
Energetische Betrachtung der radikalischen Substitution
Die Reaktion verläuft in mehreren Schritten. Man spricht von Zwischenschritten, bzw. Übergangsstufen. Jedem Schritt ist natürlich dann auch ein Abschnitt im Energiediagramm zuzuordnen.

Berechnung der Gesamtenergie der Reaktion:
Auch die Spaltung einzelner Bindungen kann betrachtet werden. Da Du aus der 10. Klasse schon weißt, dass das Zustandekommen von neuen Bindungen Energie freisetzt, ist es nur logisch, dass auch der gegenteilige Prozess, die Bindungsspaltung Energie benötigt.
Dies ist leicht vorstellbar: Will man zwei verbundene Gegenstände trennen, z.B. zwei Legosteine, so muss man etwas Energie aufbringen, um die Bindung zu lösen.
| Bindung | Bindungsenergie |
|---|---|
| C-H | 440 kJ/mol |
| F-F | Bindung (homolytisch): 159 kJ/mol |
| H-H | Bindung: 436 kJ/mol |
| Cl-Cl | Bindung (homolytisch): 242 kJ/mol |
| N-H | Bindung: 391 kJ/mol |
| Br-Br | Bindung (homolytisch): 193 kJ/mol |
| O-H | Bindung: 463 kJ/mol |
| I-I | Bindung (homolytisch): 151 kJ/mol |
| Bindung | Bindungsenergie |
|---|---|
| H-F | Bindung:-565 kJ/mol |
| C-F | Bindung:-465 kJ/mol |
| H-Cl | Bindung: -432 kJ/mol |
| C-Cl | Bindung:-360 kJ/mol |
| H-Br | Bindung: -365 kJ/mol |
| C-Br | Bindung:-290 kJ/mol |
| H-I | Bindung: -151 kJ/mol |
| C-I | Bindung:-240 kJ/mol |
Diese Energien werden auch Bildungsenthalpien genannt.
Die Gesamtenergie einer radikalischen Substitution kann man nun leicht berechnen:
- ESpaltung der C-H Bindung des Pentans + EBildung der H-Br Bindung + ESpaltung von Br2 + EBildung der Pentan-Br Bindung = EGes
- 440 kJ/mol + (- 365 kJ/mol) + 193 kJ/mol + (-298 kJ/mol) = -30 kJ/mol
- Aufgaben
- Berechne die Energie der Chlorierung von Ethan
- Berechne die Energie der Iodierung von Methan
- Warum sind radikalische Substitutionen im Labor besonders gefährlich? Berechne die freiwerdende Energie an einem beliebigem Beispiel
Halogenalkane
Als Halogene bezeichnet man die Elemente der 7. Hauptgruppe (F, Cl, Br, I, At). Die ersten vier Elemente dieser HG reagieren z.B. durch eine radikalische Substitution mit Alkanen (aber auch z.B. in Additionen mit Alkenen). Bei diesen Reaktionen entstehen einfach oder mehrfach Substituierte Halogenalkane.
Da die Halogenatome innerhalb der Verbindungen wesentlich die Eigenschaften der Alkane verändern/ bestimmen, spricht man auch von einer funktionellen Gruppe.
Halogenalkane sind einerseits wichtige Zwischenprodukte für weitere chemische Synthesen, andererseits werden sie aufgrund ihrer besonderen Eigenschaften auch als Endprodukte eingesetzt.
Gerade mehrfach halogenierte Alkane sind schlecht brennbar und fanden früher oft Verwendung in Löschmitteln.
- Bekannte Verbindungen sind
- CHCl3 Chloroform (=Trichlormethan), süßlich riechende Flüssigkeit, früher als Narkosemittel einigesetzt)
- CHI3Iodoform, leicht gelbe, charakteristisch riechende Flüssigkeit, Verwendung zur Desinfektion
- CCl4Tetrachlorkohlenstoff (=Tetrachlormethan), eine nicht brennbare Verbindung von süßlichem Geruch (Lösungsmittel, Feuerlöschmittel).
Fluor-Chlor-Kohlenwasserstoffen
Enthalten Alkane sowohl Fluor und Chlor als funktionelle Gruppe, spricht man auch von FCKWs (=Fluor-Chlor-Kohlenwasserstoffen). Manchmal werden sie auch, um den der exakten Nomenklatur gerecht zu werden CFKW genannt. Sie würden vor ihrem Verbot oft als Treibgase in Spraydosen oder Kältemittel verwendet werden. FCKWs sind sehr beständig, unbrennbar und sind meist ungiftig.
CF2Cl2leicht zu verflüssigendes Gas, Einsatz früher als Kühlflüssigkeiten in Kühlschränken.
Verbot der FCKWs
Aufgrund schädlichen Wirkung auf die Ozonschicht unserer Atmosphäre, welche alle Lebewesen in einer Höhe von 12-20km vor aggressiven UV-Strahlen schützt, wurden FCKWs 1995 weltweit verboten. Die chemische Stabilität macht diese Gase in der Atmosphäre nur schwer abbaubar (mittlere Verweildauer je nach Produkt zwischen 44-180 Jahre). Aus diesem Grunde wird die Ozonschicht auch in den kommenden Jahren weiter abnehmen, da sich nach wie vor große FCKW Mengen in ihr befinden.
Eine andere Möglichkeiten der Halogenierung
Elektrophile Substitution von Ethanol: C2H5OH + HCl → C2H5Cl + H2O
- Zusatzinformation
Halogenkohlenwasserstoffe Halogenalkane Fluorchlorkohlenwasserstoffe Tetrachlormethan Trichlorfluormethan Ozonloch Ozonschicht
Nomenklatur der Halogenalkane
- Die Nomenklatur entspricht den Regeln der üblichen Nomenklatur der Alkane (d.h. zuerst längste Kette suchen, alphabetisches Sortieren der Reste usw...)
- Der Name des Halogens (Fluor, Chlor, Brom, Iod) wird vor den Namen (evtl. mit di, tri, tetra usw...) vorangestellt. Die Nummer wird entsprechend den Regeln zur Bestimmung von Verzweigungen bei Alkanen angegeben. Also z.B. „2-Chlor-Propan“
- Bei Halogensubstituenten und Verzweigungen (z. B. Ethyl- und Chlor-Verzweigungen in einem Molekül) wird das Halogen als „funktionelle Gruppe“ zuerst genannt.
- Aufgaben
- Leite aus Formeln und Namen die Regeln für die Nomenklatur der Halogenalkane ab!
- Zeichne die folgenden Verbindungen (mit allen freien Elektronenpaaren):
- a) 3,4-di-Brom,1-Fluor-Hepen
- b) 2-Chlor,4-Ethyl,3-Methyl-Heptan
- c) 4-Brom-2,2,4-Triiod-Nonan
- d) 4-Brom-(2,5)-Octdien
- Welches Alkan hat eine molare Masse von 58g/mol? Welche Masse hätte dies Alkan als 2fach mit Fluor substituiertes? (Welches Alken hat die Masse von 84 g/mol?)
- a) Erstelle den Reaktionsweg einer Chlorierung von Propan. Wie viel verschiedene Produkte sind denkbar? Zähle mindestens 8 auf!
- b) Erstelle ein passendes Energiediagramm und erkläre die Begriffe exotherm und endotherm.
- c) Warum sind die Übergangsprodukte nicht isolierbar?
- Die Bromierung von Pentan funktioniert besonders gut, wenn das Reaktionsgemisch lange belichtet wird. Erkläre, warum bei einer kurzen Belichtungsdauer die Produktausbeute geringer ist.
-
- a) Wenn der Versuch nur mit rotem Licht oder nur mit blauem Licht bestrahlt wird, gibt es einen Unterschied in der Ausbeute. Erkläre.
- b) Wie müsste die Ausbeute der beiden Versuche im Vergleich mit weißem Licht sein?
Die elektrophile Addition
V: Zu einem Alken wird etwas Brom oder Bromwasser gegeben.
B: Es findet eine Entfärbung statt.
S: Diese sehr typische und schnell verlaufende Nachweisreaktion für Mehrfachbindungen ist keine Substitution, da man nach der Reaktion keine Doppelbindungen mehr vorfindet. Vielmehr wird die Doppelbindung aufgespalten und es werden Bromatome an das Kohlenstoffgerüst addiert. Man spricht von einer Additionsreaktion. Da nun kein freies (gelbes) Brom mehr im Reaktionsgefäß vorhanden ist, entfärbt sich die Lösung.
Zum Verständnis des genauen Ablaufs wird der Einfachheit halber nicht von Penten ausgegangen, sondern von Ethen. Grundsätzlich ist dieser Mechanismus aber an allen Alkenen gleich!
Mechanismus der elektrophile Addition am Beispiel des Ethen:
- Kurzzeitige Dipole beim Brom sorgen für eine Anziehung zwischen dem elektropositiveren Bromatom und der Doppelbindung, welche ja eine geballte „Ladung“ von Elektronen auf wenig Raum darstellt und somit minimal negativ geladen ist.
- Als Folge wird das Brommolekül heterolytisch gespalten (in Br+ und Br-).
- Das positivere Bromion wird von der Doppelbindung angezogen und bildet einen Übergangskomplex mit dem Ethen. Die Doppelbindung wird dabei aufgespalten.
- Es bildet sich eine feste Bindung zwischen dem unteren Kohlenstoff und dem Bromion, da die Doppelbindung sozusagen wie ein Fensterladen „aufklappt“. In der Folge ist das obere C-Atom allerdings nur noch dreibindig und somit positiv geladen (=Carbeniumion). Die fehlende Bindung bringt das zweite (negative) Bromion mit.
- Kohlenstoff und Brom vereinigen sich. Es ist ein Alkan entstanden. Die Doppelbindung ist nicht mehr vorhanden. Ihre Elektronen sind nun ein Teil der Bindungen zu einem Bromatom.
- Hinweise
- Additionen finden an Doppelbindungen und Dreifachbindungen statt.
- Auch H2, Halogenwasserstoffe (z.B. HCl), H2O und ähnliche Stoffe, können Additionen auslösen
- Man spricht von einer elektrophilen Reaktion, da diese durch elektrostatische Ladungen (positive und negative Ladungen) induziert wird und Ladungen auch im weiteren Reaktionsverlauf eine Rolle spielen.
- Das Hauptmerkmal der elektrophilen Addition ist der Angriff eines „Elektrophilen“, also eines positiv geladenen Teilchens.
- Dem gegenüber gibt es noch die nukleophile Substitutuion. Hier greift ein negatives Teilchen die positive Ladung des Nukleus (=Atomkerns) der Kohlenwasserstoffkette an.
- Typische nukleophile Angriffe gehen von Sauerstoff (z.B. bei einer Hydratisierung), Stickstoff (bei der Addition von Aminen NH2), dem Carbo(An)ion oder Schwefel aus
Beispiele für Additionsreaktionen
- Hydrierung: Addition von Wasserstoffionen
- Halogenierung: Addition von Halogenenionen
- Hydrohalogenierung: Addition von HF, HCl, HBr oder HI
- Hydratisierung: Addition von Wasser
- Sulfonierung: Addition von Schwefeltrioxid (SO3)2-
- Addition von Schwefelsäure
- Aufgaben
- Welche Produkte entstehen bei der Reaktion von 2-Buten mit HCl?
- Würde man stattdessen 3-Hexen nehmen, wäre das Ergebnis dann vergleichbar?
- Führe eine Addition an 1-Hexenol durch. Wie viel verschiedene Produkte erhält man?
- Erkläre das Energiediagramm der Addition
- komplexere Additionen: Isobuten Toluol und Hexen mit HCl, HBr
- Zusatzinformationen
Elektrophile Addition Nukleophile Addition Carbeniumion Carbokation
Zwei Carbokationen - Carbeniumion und Carboniumion
Als Carbokationen bezeichnet man positiv geladene Kohlenstoffatome in Kohlenwasserstoffmolekülen.
Man unterscheidet zwischen Carbeniumionen mit drei Substituenten und Carboniumionen mit fünf Bindungen.
- Zusatzinformationen
Die Eliminierung
Die Eliminierung ist ein weiterer Reaktionsmechanismus organischer Substanzen. Bei der Eliminierung wird aus einem Alkan ein Alken, es findet also die Bildung von Mehrfachbindungen statt.
Ein einfaches Beispiel ist die Eliminierung von Alkoholen. So ist es leicht, mit Schwefelsäure aus Propanol Ethen zu bilden.
- Mechanismus der Eliminierung
Der Mechanismus ist relativ leicht verständlich. Die Schwefelsäure löst die Reaktion aus, da sie eine recht hohe Affinität zu Laugen (also Hydroxiden (=OH)-) hat. Die alkoholische Hydroxidgruppe trennt sich mit dem Elektronenpaar vom Alken und hinterlässt einen dreibindigen Kohlenstoff. Das Molekül gleicht es dadurch aus, dass es ein Wasserstoffatom ohne Elektron (also ein Proton) abspaltet und diese Bindung dazu nutzt, eine Doppelbindung zu bilden. So haben wieder alle Kohlenstoffe in der Verbindung Edelgaskonfiguration. Ein Alken ist entstanden.
Das freigewordene Proton sowie ein Proton der Schwefelsäure verbinden sich gemeinsam mit der Hydroxidgruppe. Sie bilden H3O+. Aus der Schwefelsäure wurde der Säurerest Hydrogensulfat.
Tipp: Bei heterolytischen Spaltungen bekommt in der Regel der elektronegativere Bindungspartner das Bindungselektronenpaar zugeteilt.
- Aufgaben
- Zeichne die folgenden Verbindungen (mit allen freien Elektronenpaaren):
- a) 2,3 di Brom, 1Fluor Hexen (3)
- b) 2 Chlor, 4 Ethyl, 3 Methyl Heptan
- c) 4 Brom, 2,2,4, Triiod Nonan
- d) 4 Brom Oktdien (2, 5)
- Welches Alkan hat eine molare Masse von 58g/mol? (Welches Alken hat 84 g/mol?)
-
- a) Erstelle den Reaktionsweg einer Chlorierung von Propan. Wie viel verschiedene Produkte sind denkbar?
- b) Erstelle ein passendes Energiediagramm und erkläre die Begriffe exotherm und endotherm.
- c) Warum sind die Übergangsprodukte nicht isolierbar?
- Die Bromierung von Pentan funktioniert besonders gut, wenn das Reaktionsgemisch lange belichtet wird. Erkläre, warum bei einer kurzen Belichtungsdauer die Produktausbeute geringer ist.
- Wenn der Versuch nur mit rotem Licht oder nur mit blauem Licht bestrahlt wird gibt es einen Unterschied. Erkläre.
- Erstelle eine Übersicht über die drei Dir nun bekannten Reaktionsmechanismen. Erkläre jeden Mechanismus schrittgenau und nenne jeweils mögliche Ausgangsstoffe (=Edukte) und mögliche Produkte.
Fragen zur Testvorbereitung
- Vergleiche Diamant und Graphit hinsichtlich ihrer Eigenschaften und dem Aufbau.
- Was versteht man unter der „Chemie des Kohlenstoffs“. Auf wen geht die Auftrennung der Chemie in organische und anorganische Chemie zurück?
- Beschreibe die Verbrennung organischer Substanzen am Beispiel der Verbrennung von Benzin (zur Vereinfachung Octan). Stelle eine Reaktionsgleichung auf und formuliere einen Merksatz, der dies für alle organischen Substanzen zusammenfasst.
- Stelle die Reaktionsgleichung für die Verbrennung von Methan, Ethan und Propan auf.
- Welche Konsequenzen ergeben sich aus der Reaktionsgleichung in 3. und 4. für unsere Umwelt?
- Was ist die homologe Reihe der Alkane? Wie unterscheiden sich Alkane, Alkene und Alkine? Nenne je ein Beispiel sowie die allgemeine Formel.
- Welchen Zusammenhang siehst du zwischen der Länge der Kohlenstoffkette und dem Litergewicht sowie der Siedetemperatur der homologen Reihe der Alkane.
- a) Welche Summenformel haben Cyclo-Alkane b) Alkene mit zwei Doppelbindungen)?
- Erkläre den Begriff „Isomer“ und stelle alle Isomere von Hexan auf
- Gib die Strukturformeln und Namen von 4 isomeren Alkoholen der Summenformel C4H9OH an!
- Zeichne die folgenden Strukturformeln und benenne die Substanzen:a) CH3-CHCl2 b) C2H5OH c) CH3-CH3O d) C2H3Br e) C3H7Cl f) C6H6 g) C3H8 h) C3H5Cli) C3H4COOH j) C3H3O k) Butanal l) (CH3)3CCH3 m) CH2=C(CH3)CH2F n) H3C-CH2-Br o) 1,5-Diiodpenta-1,4-dien p) 2-Fluor-3,4-dimethylhexen (3) q) 4,4, Dimethyl Heptan r) 2,3,4 Trimethyl Penten s) H3C-CH2-CH2-CH2-CH2 t) H3C-CH=CH-CH=CH-CH3 u) 2,2 Dimethyl Propan
- Begründe, warum es in der organischen Chemie eine theoretisch unendliche Anzahl an Verbindungen gibt.
- Warum ist Kohlenstoff immer vierbindig und warum darf Wasserstoff nur eine Bindung haben? Wie viele Bindungen hat Stickstoff? Wie sehen die typisch gebunden Sauerstoffe aus?
- Nenne 10 Stoffe in denen Kohlenstoff enthalten ist. Wie kann man Kohlenstoff in ihnen chemisch nachweisen? Beschreibe ein Experiment. (Wie kann man Halogene in Kohlenwasserstoffen nachweisen?)
- Welche Gefahr geht von den Dämpfen kohlenstoffhaltiger Lösungsmittel (z.B. Benzin oder Alkohol) aus?
- Erstelle eine Übersicht über die drei Dir nun bekannten Reaktionsmechanismen. Erkläre jeden Mechanismus schrittgenau und nenne jeweils mögliche Ausgangsstoffe (=Edukte) und mögliche Produkte.
- Erstelle den genauen Mechanismus der Bildung von 1-Chlor-Hexan aus Hexan. Achte darauf, keine Fehler zu machen! Lerne an diesem Beispiel ordentlich und gewissenhaft zu zeichnen! Jede vergessene Bindung bedeutet ein Hanuta für den Nachbarn!
- Gib eine Methode an, nach der aus 1-Butanol Buten entsteht
- Wie kann man Brombutan herstellen? Nenne verschiede Wege
- Formuliere die Iodierung von Ethan. Nenne mindestens drei mögliche Abbruchreaktionen
- Formuliere einen chemischen Syntheseweg zur Herstellung von Ethanol. Wie wird Alkohol eigentlich üblicherweise hergestellt?
- Nenne Verwendungszwecke von Carbonsäuren und Aldehyden.
- Wozu wird Glycerin, Aceton, Ethanal, Ameisensäure und Octan verwendet?
- Nenne eine Methode zur Darstellung von Ethan-1,2-diol (=Glycol)
- Beschreibe den Reaktionsmechanismus und die Reaktionsbedingungen der folgenden Reaktion: CH2Cl–CH3–CH3 + ........ → ...... → H2C=CH–CH3
- Vervollständige die Reaktionsgleichung (und gib Pfeile über die sich bewegenden Atome an und benennen Edukte und Produkte: (CH3)3C-OH + H2SO4 → ...
- Welche zwischenmolekularen Kräfte gibt es? Beschreibe Sie und ordne sie hinsichtlich ihrer zunehmenden Wirkungsstärke
- Vergleiche die zwischenmolekularen Kräfte von Methanol und Oktanol.
- Ordne Wasser, Methanol und Diethylether nach Molekülmassen und vergleiche deren Siedepunkte. Kann man diesen Widerspruch erklären?
- Beurteile die Löslichkeit folgender Substanzen in Wasser: Methansäure, 1-Octanol, Ethansäuremethylester, 2-Propansäure
- Was versteht man unter Viskosität? Erkläre und nenne Beispiele.
- Inwiefern hat der räumliche Bau eines Moleküls Einfluss auf dessen polaren Charakter? Begründe am Beispiel von CCl4, CO2 und HF.
- Welche Art von Bindung liegt im Chloroform-Molekül (CCl3) vor?
- Erkläre, warum sich Alkane nicht in Wasser, sehr wohl aber in Öl und Fett lösen. Benutze dazu die folgenden Begriffe: Hydrophob, hydrophil, lipophob, lipophil, Dipol-Dipol-Wechselwirkungen, räumlicher Bau und Abstoßung.
- Erkläre das Zustandekommen von zwei Phasen beim Mischen von Alkanen mit Schwefelsäure.
- Was erwartest Du, wenn man Kochsalz in Benzin gibt und kräftig rührt? Begründe.
- Wie entstehen Van-Der-Waals-Kräfte? Welchen Einfluss haben Sie und wie entstehen sie?
- „Die unterschiedliche Entzündbarkeit der flüssigen Alkane entspricht der homologen Reihe und ist von den Massen und den Van-der-Waals-Kräften abhängig“. Stimmt diese Aussage? Begründe!
- Welche Faktoren bestimmen Smp und Sdp? Begründe mit Hilfe des Teilchenmodells und der Brownsch'schen Molekularbewegung. In welcher Form spielt die zugeführte Energie dabei eine Rolle?
- Nenne und vergleiche die Eigenschaften von Alkanen, Alkinen und Alkenen erst allgemein und dann am Beispiel von Ethan, Ethen und Ethin.
- Was sind Halogenalkane für Stoffe. Beschreibe die Stoffklasse.
- Nenne die Summenformeln von Paraffin, Aceton, Ether (Diethylether), Glycerin.
- Lerne die Formeln der Säuren „Chlorwasserstoff“, „Bromwasserstoff“, „Iodwasserstoff“ und „Schwefelwasserstoff“.
| Stoffklasse | funktionelle Gruppe | Endung | Beispiel |
|---|---|---|---|
| Alkan | C-C | ||
| Alken | |||
| Alkin | |||
| Alkohol | |||
| Carbonsäure | |||
| Halogenalkane |
- ↑ Achtung: freiwerdende Energien bekommen ein negatives Vorzeichen! Benötigte Energien ein positives!
Organische Verbindungen mit funktionellen Gruppen
Übersicht über wichtige Stoffklassen der organischen Chemie
Es gibt zwei Möglichkeiten der Nomenklatur bei Estern:
Da Ester durch die Reaktion von Alkohol mit Säuren entstehen, bilden sich die Namen entsprechend: Rest des Alkohols + Rest der Säure + oat (früher: Säurename + Restname + Ester)
Es gibt zwei Möglichkeiten der Nomenklatur bei Ethern:
Ether werden als Alkoxyalkane bezeichnet. Dabei wird der längere Alkyl-Rest als Stamm und der kürzere Rest als Alkoxy-Substituent benannt (früher: Name aus den beiden Alkyl-Resten + -ether).
Übersicht über die funktionellen Gruppen
Als Funktionelle Gruppen bezeichnet man besondere Atome, die anstelle eines Wasserstoffes an eine Kohlenwasserstoffkette angehängt ist. Die funktionellen Gruppen sind entscheidend für die chemischen Eigenschaften und das chemische Verhalten dieser Verbindung. So kann ein einzelnes Chloratom die Eigenschaften einer Kohlenstoffkette aus 10 Kohlenstoffatomen komplett verändern.
Oft werden auch spezielle Bindungsarten (Doppel-, Dreifachbindung sowie Ringschlüsse) zu den funktionellen Gruppen zugeordnet.
| Funktionelle Gruppe | Name |
|---|---|
| Aromatische Ringe | Aromaten |
| aromatischer Ring mit -OH | Phenole |
| R-C≡N | Nitrile |
| R-CO | Ketone |
| R-COH | Aldehyde |
| R-COOH | Carbonsäuren |
| R-COO-R’ | Ester |
| R-Hal (F, Cl, Br, oder I) | Halogenkohlenwasserstoffe |
| Ringschluss | Cycloalkane |
| R-N=N-R’ | Azoverbindungen |
| R-N=O | Nitrosoverbindungen |
| R-NH2 | Amin |
| R-NO2 | Nitroverbindungen |
| R-O-C≡N | Cyanat |
| R-OH | Alkohole |
| R-O-O-R’ | Peroxide |
| R-O-R’ | Ether |
| R-O-SO2-O-R | Sulfate |
| R-SH | Thiole (bzw. Mercaptane) |
| R-SO2-R’ | Sulfone |
| R-SO3H | Sulfonsäure |
| R-S-R’ | Thioether |
| R-S-S-R’ | Disulfide |
Beachte: R (bzw. R’) kennzeichnen beliebige Kohlenwasserstoffketten als Rest
Übersicht über wichtige funktionelle Gruppen und bekannte Vertreter
| Name/ funktionelle Gruppe |
Beispiele | Verwendung und Besonderheiten |
|---|---|---|
| Alkohole [-ol] | Methanol | Früher bekannt als Methylalkohol oder Holzgeist. Hochgiftige, farblose, leicht brennbare Flüssigkeit. Sie wird schon durch Hautkontakt in den Körper aufgenommen. Schon kleinste Mengen führen zu Nervenschäden und Erblindung. Mengen ab ca. 5ml sind tödlich.
Ein Erkennungsmerkmal ist die Verbrennung mit leicht bläulicher Flamme. Ein weiterer Nachweis (und eine Unterscheidung zu Ethanol ist die Verbrennung mit Borax. Dabei entsteht Trimethylborat, das mit grüner Flamme verbrennt. Es findet Verwendung als Lösungs- und Reinigungsmittel, als Treibstoff und Benzinersatz. Zusatzinformationen: Methanol |
| Ethanol | Der bekannteste Alkohol wurde früher auch Ethylalkohol oder Weingeist genannt. Er ist ein sehr wichtiges Lösungsmittel, Bestandteil von Reinigungsmitteln und Ausgangsstoff für viele chemische Synthesen.
Als Genussmittel wird in den meisten Ländern Alkoholsteuer darauf erhoben. Damit er trotzdem für andere Zwecke, wie z.B. zum Reinigen von Fenstern, zur Verfügung steht, wird er als Spiritus mit einem Vergällungsstoff in den Handel gebracht. Dieser ist ungenießbar. Ethanol ist giftig. Zwar kann die Leber und die darin gespeicherten Enzyme (z.B. Alkoholdehydrogenase) das Blut wieder entgiften, aber schon ein Glas Wein/ Bier lässt Menschen (je nach Gewicht) die typischen Vergiftungserscheinungen spüren (Schwindel, Übelkeit, Orientierungsstörung, gesteigerte Aggressivität usw.). Die tödliche Dosis liegt etwa bei 3,0 bis 4,0 Promille. Zusatzinformationen: Ethanol | |
| Glycerin | Glycerin (bzw. Glycerol) ist der Trivialname von Propantriol. Dieser dreiwertige Alkohol ist eine wichtige Ausgangssubstanz für Cremes und andere Kosmetika. Es wirkt als Frostschutzmittel in Scheibenwischanlagen und kann bei der Kunststoffproduktion als Weichmacher verwendet werden. Man findet es auch in Zahnpasta und vielen natürlichen Lipiden (Fetten).
Zusatzinformationen: Glycerin |
| Name/ funktionelle Gruppe |
Beispiele | Verwendung und Besonderheiten |
|---|---|---|
| Aldehyde [-al] | Methanal (=Formaldehyd) | Formaldehyd ist ein farbloses, stechend riechendes Gas, welches schwerer als Luft ist. In geringen Mengen riecht es etwas süßlich. Es ist ein gutes Reduktionsmittel und noch in Konzentrationen von 0,05-1 ml/m³ wahrnehmbar.
Bei Hautkontakt oder beim Einatmen kommt es zu Verätzungen. Als tödliche Menge reichen schon ca. 10ml Lösung. In geringeren Mengen ist es immer noch krebserregend und kann außerdem Allergien, Haut-, Atemwegs- oder Augenreizungen verursachen. Es wird zur Herstellung von Kunststoffen, Düngemitteln, Farbstoffen, Konservierungsstoff in der Kosmetikindustrie, Desinfektionsmitteln usw. verwendet. Früher würde es gepresstem Holz beigefügt, um dieses vor Schimmel und Insektenbefall zu schützen. Alte Möbel aus gepresstem Holz können auch noch Jahrzehnte später Formaldehyd ausdünsten. Zusatzinformationen: Formaldehyd |
| Ethanal (=Acetaldehyd) | Ethanal ist eine farblose, sehr leicht flüchtige und daher leicht entzündliche Flüssigkeit mit betäubendem, stechendem Geruch, die mit Wasser in jedem Verhältnis mischbar ist.
Beim Abbau von Alkohol in der Leber entsteht Ethanal als Zwischenprodukt. größere Mengen davon sind u.a. (neben Magnesiummangel im Blut) für den Kater am nächsten Morgen mitverantwortlich. Es entsteht ebenso (neben über 1000 anderen Verbindungen) bei der Verbrennung von Tabak. Es ist Bestandteil von Kunststoffen (Synthesekautschuk) Farben und wird zur Herstellung von Parfümen verwendet. Auch in der Gummi-, Papier- und Lederindustrie wird es eingesetzt. Manchmal wird es auch als Konservierungsstoff von Früchten und Fisch verwendet. | |
| Ketone [-on] | Aceton | Aceton ist eine dünnflüssige, farblose Flüssigkeit mit typischem Geruch. Sie ist sehr leicht flüchtig und leicht entzündlich und bildet mit Luft ein explosives Gemisch. Mit Wasser ist sie in jedem Verhältnis mischbar und wird deshalb auch oft als Lösungsmittel verwendet (besonders für Harze, Fette, Öle, Klebstoffe, Lacke und Farben). Früher wurde es häufig als Nagellackentferner eingesetzt
Zusatzinformationen: Aceton |
| Name/ funktionelle Gruppe |
Beispiele | Verwendung und Besonderheiten |
|---|---|---|
| Carbonsäure [-säure] | Ameisensäure | Ameisensäure ist eine farblose, ätzende, stark riechende und in Wasser lösliche Flüssigkeit, die in der Natur vielfach von Lebewesen zu Verteidigungszwecken genutzt wird. Ameisensäure ist ein starkes Reduktionsmittel.
Mit Wasser ist sie in jedem Verhältnis mischbar. Als Konservierungsstoff für die Lebensmittelindustrie trägt es die Nummer E 236. Ihr Säurerest heißt Formiat. Zusatzinformationen: Ameisensäure |
| Ethansäure (=Essigsäure) | Reine Essigsäure ist eine stark riechende Flüssigkeit, die schon bei 16,5°C erstarrt. Sie wird dann auch als Eisessig bezeichnet. Sie hat eine recht hohe ätzende Wirkung und greift unter anderem Kalk und Metalle an.
Sie ist in jedem Verhältnis mit Wasser mischbar. Wässrige Lösungen der Essigsäure werden auch Essig genannt. Der Essig im Handel enthält zwischen 5-15% Essigsäure. Als Konservierungsstoff für die Lebensmittelindustrie trägt es die Nummer E 260. Die Salze der Essigsäure werden als Acetate bezeichnet. Zusatzinformationen: | |
| Weitere Säuren: | An Carbonsäuren gibt es eine zu große Vielfalt, um alle wichtigen Vertreter hier aufzulisten. Aus diesem Grunde folgt nur eine Kurzübersicht.
Kurzkettige Carbonsäuren sind stark polar. Langkettige Carbonsäuren haben ein polares und ein unpolares Ende der Kohlenwasserstoffkette. Die mit Mehrfachbindungen werden ungesättigten Fettsäuren genannt. Ohne Doppelbindungen als gesättigte Fettsäuren). Komplexe Carbonsäuren, wie sie oft auch in der Natur in Pflanzen oder beim Stoffwechseln von Tieren auftreten können auch 2 Säuregruppen bzw. auch Hydroxidgruppen enthalten. Sie bilden sie untereinander Wasserstoffbrückenbindungen aus und haben u.a. deshalb hohe Siedepunkte. Bei langkettigen Carbonsäuren haben auch die Van-der-Waals-Kräfte größen Einfluss auf die hohen Schmelz- und Siedepunkte Zusatzinformationen: Carbonsäuren | |
| Propionsäure
CH3-CH2-COOH |
Konservierungsmittel, kaum noch verwendet (E 280), Säurerest: Propionate | |
| Milchsäure
CH3-CHOH-COOH |
Bestandteil des Säureschutzmantels der Haut. Entsteht beim sauer werden von Milch, Kochsalzersatz in der Diätnahrung (E 270), Säurerest: Lactate | |
| Buttersäure
CH3-CH2-CH2-COOH |
Einsatz bei der Kunststoffherstellung, Säurerest: Butyrate | |
| Weinsäure | HOOC-CHOH-CHOH-COOH
Bestandteil in Weintrauben, Säuerungsmittel in der Lebensmittelindustrie (E 334), Säurerest: Tartrate | |
| Citronensäure
C6H8O7 · H2O |
Konservierungsstoff und Säuerungsmittel (E 330), Säurerest: Citrate | |
| Benzoesäure
C6H5COOH |
Lebensmittel-Konservierung (E 210) , Säurerest: Benzoate | |
| Stearinsäure
C18H36O2 |
Seifen- und Kerzenwachsherstellung, Säurerest: Stearate | |
| Ether [-'ether] | Diethylether (oft auch einfach nur „Ether“ genannt) | Diethylether riecht leicht süßlich und wird vom Geruch oft mit dem Geruch von „Zahnarztpraxen“ in Verbindung gebracht. Es ist eine klare, farblose Flüssigkeit, welche bei Raumtemperatur sehr schnell verdunstet.
Beim Einatmen hat gasförmiger Dieethylether eine betäubende Wirkung, so dass er ab 1846 von Ärzten als Narkotikum (4-5-Vol% Diethylether in der Atmeluft, mindestens 15g) Die Wirkung ist dabei eine Lähmung des ZNS, so dass es zu Bewusstseinsverlust und Schmerzunempfindlichkeit kommt. In der Bevölkung hieß der Stoff von da an auch vereinfacht „Ether“. Der Vorteil dieses Betäubungsmittels ist, dass er Atmung und Blutkreislauf nur kaum beeinträchtigt, so dass die Patienten zwar mit Kopfschmerzen, aber sonst gesund aus der Narkose erwachten. Die Gefahr lag darin, dass Dieethyletherdämpfe mit Luft ein explosives Gemisch bilden. Diethylether ist recht apolar, so dass er ein gutes Lösungsmittel für lipophile Stoffe und ein schlechtes für Wasser und hydrophile Stoffe darstellt. Diethylether entzündet sich bereits als Gemisch mit Luft bei 180 °C von selbst! Beim Stehenlassen bilden sich in Vorratsflaschen Peroxidverbindungen (R-O-O-R). Diese sind ebenfalls gefährlich und steigern die Explosivität. |
| Ester [-ester] | Essigsäureethylester (=Ethylacetat) | Ester sind meiste klare farblose Flüssigkeiten. So auch der Essigsäureethylester. Er ist teilweise in Nagellackentferner enthalten und ist auch in vielen Klebstoffen als Lösungsmittel enthalten.
Wenn man davon viel einatmet, reizt das die Atemwege, wirkt narkotisierend/ betäubend und kann auch beim regelmäßigen Schnüffeln abhängig machen. Essigsäureethylester löst sich etwas in Wasser und löst sich vor allem in Ölen und Fetten (lipophile Stoffe). Man findet es neben der Verwendung als Lösungsmittel in geringen Konzentrationen auch als künstlichen Fruchtaromastoff in Lebensmitteln sowie bei der Kunststoffherstellung (Kunstharze, Cellophan, Celluloid) |
Fragen zur Testvorbereitung
- Vergleiche Diamant und Graphit hinsichtlich ihrer Eigenschaften und dem Aufbau.
- Was versteht man unter der „Chemie des Kohlenstoffs“. Auf wen geht die Auftrennung der Chemie in organische und anorganische Chemie zurück?
- Beschreibe die Verbrennung organischer Substanzen am Beispiel der Verbrennung von Benzin (zur Vereinfachung Octan). Stelle eine Reaktionsgleichung auf und formuliere einen Merksatz, der dies für alle organischen Substanzen zusammenfasst.
- Stelle die RG für die Verbrennung von Methan, Ethan und Propan auf
- Welche Konsequenzen ergeben sich aus der Reaktionsgleichung in 3. und 4. für unsere Umwelt?
- Was ist die homologe Reihe der Alkane? Wie unterscheiden sich Alkane, Alkene und Alkine? Nenne je ein Beispiel sowie die allgemeine Formel.
- Welchen Zusammenhang siehst du zwischen der Länge der Kohlenstoffkette und dem Litergewicht sowie der Siedetemperatur der homologen Reihe der Alkane.
- a) Welche Summenformel haben Cyclo-Alkane b) Alkene mit zwei Doppelbindungen)?
- Erkläre den Begriff „Isomer“ und stelle alle Isomere von Hexan auf
- Gib die Strukturformeln und Namen von 4 isomeren Alkoholen der Summenformel C4H11OH an!
- Zeichne die folgenden Strukturformeln und benenne die Substanzen:a) CH3-CHCl2 b) C2H5OH c) CH3-CH4O d) C2H3Br e) C3H8Cl f) C6H6 g) C3H8 h) C3H5Cli) C3H4COOH j) C3H3O k) Butanal l) (CH3)3CCH3 m) CH2=C(CH3)CH2F n) H3C-CH2-Br o) 1,5-Diiodpenta-1,4-dien p) 2-Fluor-3,4-dimethylhex-3-en q) 4,4, Dimethyl Heptan r) 2,3,4 Trimethyl Penten s) H3C-CH2-CH2-CH2-CH2 t) H3C-CH=CH-CH=CH-CH3 u) 2,2 Dimethyl Propan
- Begründe, warum es in der organischen Chemie eine theoretisch unendliche Anzahl an Verbindungen gibt.
- Warum ist Kohlenstoff immer vierbindig und warum darf Wasserstoff nur eine Bindung haben? Wie viele Bindungen hat Stickstoff? Wie sehen die typisch gebunden Sauerstoffe aus?
- Nenne 10 Stoffe in denen Kohlenstoff enthalten ist. Wie kann man Kohlenstoff in ihnen chemisch nachweisen? Beschreibe ein Experiment. (Wie kann man Halogene in Kohlenwasserstoffen nachweisen?)
- Welche Gefahr geht von den Dämpfen kohlenstoffhaltiger Lösungsmittel (z.B. Benzin oder Alkohol) aus?
- Erstelle eine Übersicht über die drei Dir nun bekannten Reaktionsmechanismen. Erkläre jeden Mechanismus schrittgenau. und nenne jeweils mögliche Ausgangstoffe (=Edukte) und mögliche Produkte.
- Gib eine Methode an, nach der aus 1-Butanol Buten entsteht
- Wie kann man Brombutan herstellen? Nenne verschiedene Wege
- Formuliere die Iodierung von Ethan. Nenne mindestens drei mögliche Abbruchreaktionen
- Warum gibt es unter Umständen hunderte von Produkten? Nenne ein paar Beispiele, die dies verdeutlichen.
- Formuliere einen chemischen Syntheseweg zur Herstellung von Ethanol. Wie wird Alkohol eigentlich üblicherweise hergestellt?
- Nenne Verwendungszwecke von Carbonsäuren und Aldehyden.
- Wozu wird Glycerin, Aceton, Ethanal, Ameisensäure und Octan verwendet?
- Nenne eine Methode zur Darstellung von Ethan-1,2-diol (=Glycol)
- Beschreibe den Reaktionsmechanismus und die Reaktionsbedingungen der folgenden Reaktion: CH2Cl-CH2-CH3 + _________________ → _________________ → H2C = CH – CH3 + _________________
- Vervollständige die Reaktionsgleichung (und gib Pfeile über die sich bewegenden Atome an und benennen Edukte und Produkte: (CH3)3C-OH + H2SO4 → ...
- Welche zwischenmolekularen Kräfte gibt es? Beschreibe Sie und ordne sie hinsichtlich ihrer zunehmenden Wirkungsstärke
- Vergleiche die von Methanol und Oktanol in Wasser.
- Ordne Wasser, Methanol und Diethylether nach Molekülmassen und vergleiche deren Siedepunkte. Kann man diesen Widerspruch erklären?
- Beurteile die Löslichkeit folgender Substanzen in Wasser: Methansäure, 1-Octanol, Ethansäuremethylester, 2-Propansäure
- Was versteht man unter Viskosität? Erkläre und nenne Beispiele.
- Wiederhole die Regeln der Nomenklatur und benenne die folgenden Verbindungen
| Stoffklasse | funktionelle Gruppe | Endung | Beispiel |
|---|---|---|---|
| Alkan | C-C | ||
| Alken | |||
| Alkin | |||
| Alkohol | |||
| Carbonsäure | |||
| Halogenalkane |
Vertiefung
Weitere Isomerieformen
Man unterscheidet zwischen zwei Arten von Isomerie: Struktur- (bzw. Konstitutionsisomerie) und Stereoisomerie:
Konstitutionsisomerie
|
|
Stereoisomerie
 |

|
| cis-2-Penten | trans-2-Penten |
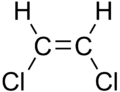 |

|
| cis-1,2-Dichloroethen | trans-1,2-Dichloroethen |
 |

|
| cis-Butendisäure (Maleinsäure) |
trans-Butendisäure (Fumarsäure) |
| (S)-Weinsäure (D-(−)-Weinsäure) |
(R)-Weinsäure (L-(+)-Weinsäure) |
meso-Weinsäure |
|---|---|---|

|

| |
|
DL-Weinsäure (racemisch) | ||

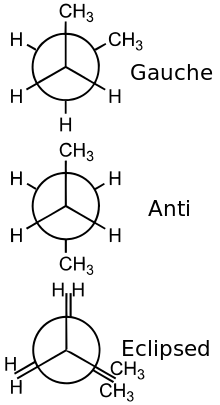
- Zusatzinformationen
Zwischenmolekulare Kräfte beeinflussen Schmelz- und Siedepunkte
- a) Allgemeine Vorgänge beim Schmelzen und Sieden
Im Anfangsunterricht Chemie des ersten Jahres hast Du gelernt dass alle Stoffe aus winzigen Atomen oder Molekülen bestehen, welche ständig zittern. Diese Brown’sche Molekularbewegung. ist von der Temperatur abhängig. Die folgende Skizze verdeutlicht noch einmal, was passiert, wenn man gefrorenes Wasser bis zum Sieden kocht.
Mit anderen Worten: Wird der Schmelzpunkt (=Smp) überschritten, lösen sich die Teilchen vom Eisblock ab, weil sie sich zu stark bewegen und sich nicht mehr gegenseitig stark genug anziehen. Der Feststoff schmilzt. Bei weiterer Erwärmung benötigen die Teilchen immer mehr Platz, bis sie schließlich am Siedepunkt (=Sdp) in die Gasphase übergehen (dort ist noch genügend Platz vorhanden).
Der Schmelz- und der Siedepunkt sind demzufolge eine Stoffeigenschaft, die von den Kräften zwischen den Atomen bzw. den Zwischenmolekularen Kräften abhängig ist. Jeder Stoff hat andere Schmelz- und Siedepunkte. Man kann dadurch Stoffe erkennen und zuordnen:
| Wasser | Alkohol | Eisen | Zink | Quecksilber | Helium | Wasserstoff | Sauerstoff | |
|---|---|---|---|---|---|---|---|---|
| Smp. | 0°C | -117°C | 1535°C | 419°C | -39°C | -272°C | -259°C | -219°C |
| Sdp. | 100°C | 79°C | 2870°C | 906°C | 357°C | -269°C | -253°C | -183°C |
- b) Mögliche Kräfte zwischen Molekülen
Im dritten Jahr Chemieunterricht hast gelernt, welche verschiedenen Arten der zwischenmolekularen Kräfte es gibt. Hier eine kurze Wiederholung.
Ionenladungen
Positive und negative Ionen ziehen sich stark an. Demzufolge haben ionogene Verbindungen auch die höchsten Schmelz- und Siedepunkte
Dipol-Dipol-Kräfte
Dipole sind schwache Ladungen innerhalb von Molekülen und kommen durch ungleiche Ladungsverteilungen zustande. Diese ungleichen Ladungsverteilungen haben ihre Ursache in den verschiedenen Elektronegativitäten der Elemente. Dipolmoleküle bilden lockere Verbände - so genannte Molekülaggregate. Die Anziehungskräfte zwischen Dipolen sind viel geringer als die zwischen Ionen und wirken nur über kurze Entfernungen.
Bsp.: CO2 hat eine mehr als doppelt so hohen Molekülmasse wie H2O. Sein Siedepunkt liegt bei -78°C. Also müsste Wasser unterhalb (!) dieser Temperatur bereits Sieden. Da die Moleküle des Wassers aber wunderbare Dipolmoleküle sind, die sich gegenseitig prima anziehen, muss wesentlich mehr Energie zum Sieden des Wassers aufgebracht werden. Es muss also demzufolge mehr Energie aufgebracht werden, diesen „Zusammenhalt“ zu spalten, damit die Moleküle in die Gasphase übertreten können. Puh, noch mal Glück gehabt, weil sonst garantiert kein Leben auf Wasserbasis entstanden wäre ;-)
Liegen Dipol-Dipol-Wechselwirkungen vor, so erhöhen sich Schmelz- und Siedepunkt.
Wasserstoffbrückenbindungen (=WBBs)


Zwischen den Wasserstoffatomen und freien Elektronenpaaren bilden sich so genannte Wasserstoffbrückenbindungen. Sie führen zu einer schwachen Anziehung zwischen den Molekülen.
WBBs bilden sich beispielsweise auch zwischen Wasserstoff und Stickstoff oder Halogenmolekülen.
Van der Waalskräfte (VdW-Kräfte)
Die Ladungen einer Atombindung in Molekülen sind wegen der Bewegung der Elektronen nicht in jedem Moment symmetrisch verteilt. Dadurch entstehen momentane, kurzzeitige Dipole, die allerdings nur sehr schwach sind und auch schnell wieder verschwinden, bzw. sich verschieben.
Sie treten nur bei Atomen und apolaren Molekülen auf. (Zum Vergleich: WBBs sind permanente Dipole).
- Die Stärke der VdW-Kräfte hängt ab von
- Anzahl der e- im Atom. Je mehr e- vorhanden sind, desto stärker kann die asymmetrische Verteilung sein, desto stärker sind folglich die Dipole.
- Zahl der Atome im Molekül (je höher die Molekülmasse, desto stärker die VdW-Kräfte)
- Zahl der Berührungsstellen zwischen zwei (oder mehr) Molekülen
- Das Zustandekommen von Van-der-Waals-Bindung ist sehr vom Abstand der Moleküle abhängig. Zwei Atome beziehungsweise Moleküle müssen sich also sehr nahe kommen, bevor es zu einer Wechselwirkung kommt.
- Diese Annäherung ist umso schwieriger, je verzweigter die Moleküle sind.
Warum liegen bei längeren Alkanketten höhere Siedepunkte vor?
Da Alkane weder Ionenbindungen, Dipol-Dipol-Bindungen noch WBBs ausbilden, nehmen nur die VdW-Kräfte Einfluss auf ihren Siedepunkt.
Wie man leicht sieht, besteht bei langkettigen Molekülen auch verstärkt die Möglichkeit VdW-Bindungen auszubilden. Sie sind zwar nur kurzzeitig, haben aber dennoch Einfluss auf Schmelz- und Siedepunkte.
- Abstufung der verschiedenen Bindungsenergien zwischen Atomen
- Van der Waals-Kräfte < Dipol-Dipol-Kräfte < WBB < Ionenbindung < Atombindung
- Zunahme der Bindungsenergie
- Zunahme der Bindungsstärke
Bedenke: Je stärker die Bindung zwischen Atomen oder Molekülen ist, desto mehr Energie wird benötigt, diese Bindung wieder aufzuspalten.
Bei der Bildung einer Bindung ist es genau umgekehrt. Der entsprechende Betrag Energie wird bei der Bindungsbildung frei.
- Aufgaben
- a) Wo liegen stärkere zwischenmolekulare Kräfte vor: H2S oder H2O? b) Wie kannst Du Deine Feststellung beweisen?
- Erkläre die unterschiedlichen Schmelz- und Siedepunkte von n-Butan und iso-Butan.
- Welcher Zusammenhang besteht zwischen Viskosität und Van der Waals Kräften?
- Aceton hat eine Viskosität von nur 0,33. Kannst Du Ursachen erkennen, die mit seinem Aufbau zu tun haben?
- Erkläre mit Hilfe von Zeichnungen Van der Waals-Kräfte und ihre Wirkung besonders auf Flüssigkeiten langkettiger Kohlenwasserstoffe
- Zusatzinformationen
Van-der-Waals-Bindung Johannes Diderik van der Waals Wasserstoffbrückenbindung Dipol-Dipol-Kräfte
Mehr zum Cyclohexan und seinem Bau
- farblose Flüssigkeit
- Sdp.: 81 °C (n-Hexan 69 °C)
- typische Alkaneigenschaften
- typische Alkanreaktionen (z.B. radikalische Substitution SR)allerdings nur ein Monosubstitutionsprodukt
- Der Cyclohexanring ist nicht planar gebaut.
Cracken von langkettigen Kohlenwasserstoffen
Die wichtigsten Rohstoffe, welche aus Erdöl gewonnen werden sind v.a. Treibstoffe wie Benzin und Diesel sowie kurzkettige (C2-C4) Kohlenwasserstoffe zur Kunststoffproduktion.
Da die Zusammensetzung von Erdöl unterschiedlich ist und der prozentuale Anteil an Benzin, Diesel und kurzkettigen Kohlenwasserstoffen in Erdöl (natürlich) nicht den menschlichen Bedürfnissen entspricht, benötigt man ein Verfahren, um aus den kaum nutzbaren langkettigen Kohlenwasserstoffketten kurzkettige, dringend benötigte herzustellen.
Ein Verfahren dazu ist das so genannte Cracken. Im Grunde wird eine lange Kohlenwasserstoffkette dabei in mehrere Kürzere durch Erhitzen auf ca. 800°C (oder durch einen Katalysator bei ca. 450°C) „zerschnitten“.
Dies funktioniert deshalb so einfach, da die Kohlenstoffatome bei solche hohen Temperaturen derart stark schwingen, so dass die Ketten „reißen“.
Zu beachten ist, dass an den Bruchstellen von langkettigen Alkanen jeweils CH2- Glieder vorliegen. Daraus folgt, dass die neuen Kettenenden der entstehenden Bruchstücke allerdings nicht immer CH3-Enden haben können! (da ja Wasserstoffatome fehlen)[1]. Als Konsequenz entstehen beim Cracken immer erstmal Alkene.
- Beispiel
- Cracken von Octan in Butan und Buten
- Zusatzinformationen
Die Genfer Nomenklatur von organischen Verbindungen (IUPAC) - Teil 2
- Für Teil 1 siehe Kapitel 4: Kohlenstoff als Bindungspartner
Nomenklatur mit Alkohole-Substituenten
- Bei Alkoholen wird das Hydroxid als Alkanderivate behandelt. Dem Namen des Alkans wird die Endung -ol angehängt. Den Platz der Hydroxidgruppe erhält wie üblich eine möglichst geringe Nummer. Wichtig: Die Namen und Ziffern der Alkylsubstituenten werden denen der Alkanolsubstituenten vorangestellt:
-
Pentan-1-ol (bzw. 1 Pentanol)
-
3-Methyl-1-Pentaol
-
Cyclohexanol
- Hydroxidgruppen, Halogengruppen sowie Alkylgruppen können entsprechend ihrer Stellung die Hauptkette als primäre, sekundäre oder tertiäre kennzeichnen. Entscheidend ist dabei immer, wie viele weitere Kohlenstoffe an dem C zu finden sind, welches die Hydroxigruppe bindet.
- Entsprechend der Anzahl der OH-Gruppen unterscheidet man einwertige, zweiwertige, dreiwertige (usw.) also mehrwertige Alkohole
-
Glycerin (dreiwertig)
-
Glycol (zweiwertig)

- Liegen die Hydroxygruppen am Benzol (C6H6) vor, so spricht man von Phenolen. Kommen zusätzlich Alkylgruppen vor, so werden sie im Namen wieder vorangestellt.
- Bei der Benennung von Verbindungen mit Alkoholsubstituenten und Mehrfachbindungen, werden zuerst die Alkoholsubstituenten genannt.
- b) Nomenklatur mit Halogen-Substituenten
- Die Nomenklatur entspricht den Regeln der üblichen Nomenklatur der Alkane (d.h. zuerst längste Kette suchen, alphabetisches Sortieren der Reste usw...)
- Der Name des Halogens (Fluor, Chlor, Brom, Iod) wird vor den Namen (evtl. mit di, tri, tetra usw...) vorangestellt. Die Nummer wird entsprechend den Regeln zur Bestimmung von Verzweigungen bei Alkanen angegeben. Also z.B. „2 Chlor-Propan“
- Bei Halogensubstituenten und Verzweigungen (z. B. Ethyl- und Chlor-Verzweigungen in einem Molekül) wird das Halogen als „funktionelle Gruppe“ zuerst genannt.
Nomenklatur mit Ether & Ester Substituenten
- Grundsätzlich gibt es hier eine neue und eine ältere (aber noch häufig verwendete Methode. Da Ester durch die Reaktion von Alkohol mit Säuren entstehen, bilden sich die Namen entsprechend: Rest des Alkohols + Rest der Säure + oat (früher: Säurename + Restname + Ether)
- Auch hier gibt es zwei entsprechende Methoden. Heute werden Ether als Alkoxyalkane bezeichnet. Dabei wird der längere Alkyl-Rest als Stamm und der kürzere Rest als Alkoxy-Substituent benannt. (früher: Name aus den beiden Alkyl-Resten + -ether)
Effekte in Molekülen
Induktive Effekte sind Polarisationseffekte, die durch elektronenanziehende oder -abstoßende Atome oder Atomgruppen bewirkt werden und über 2-3 π-Bindungen hinweg übertragen werden können. Man unterschiedet den +I-Effekt (elektronenschiebend) vom -I-Effekt (elektronenziehend).
Welcher I-Effekt vorliegt hängt von dem betrachteten „Schlüsselatom“ ab. Hat dieses Atom eine negative Partialladung so ist es Elektronen abstoßend. Bei einer positiven Partialladung ist es Elektronen anziehend.
Die "Schlüsselatome" werden oft auch als π-Akzeptoren (elektronenanziehend) oder π-Donatoren (elektronenabstoßend) bezeichnet z.B.
Je weiter die Nachbaratome vom Schlüsselatom entfernt sind, desto mehr schwächt sich die Wirkung des induktiven Effektes des Fluoratoms ab. Am stärksten wirkt er bei C1.
Erklärungen für I-Effekte
Da Elektronen freibeweglich sind, liegt im Grunde immer eine asymmetrische Verteilung von Elektronen zwischen zwei Atomen vor. Betrachtet man jetzt das Fluoratom und das C1-Atom, dann werden rein statistisch betrachtet die Elektronen zum Fluoratom hingezogen, da es elektronegativer (und somit elektronenanziehender) ist. Das elektronenanziehendere Fluor übt also einen -I-Effekt aus (sprich: negativer induktiver Effekt).
Dadurch wird die Elektronendichte bei dem anderen C1-Atom verringert! Es ist im Vergleich zu seinem Nachbarkohlenstoffatom C2 also auch minimal elektronegativer geworden. Ein Ausgleich kann geschehen, indem sich die Elektronen zwischen dem C1- und dem C2-Atom zum C1-Atom leicht verschieben. Dieser Effekt wird sogar noch weiter durch die Kohlenstoffkette wirken, schwächt sich aber dabei sehr schnell ab.
Generell kann man also sagen, dass der Fluorsubstituent das C1-Atom positiviert hat. Einen elektrophilen Angriff wird also eher am anderen Ende der Kohlenstoffkette stattfinden. Das C1-Atom eignet sich eher für einen nukleophilen Angriff.
- Übersicht über das zunehmende Vermögen Elektronen anzuziehen
(CH3)3C– <(CH3)2CH– < C2H5– <CH3– <H < –C6 H5 (Ring) < MeO– <HO– < I– < Br– <Cl– <–NO2 < F–
- elektronenschiebend (+I-Effekt) → Effekt bei H = 0 → elektronenziehend (-I-Effekt)
- Zusatzinformationen
I-Effekt Mesomerer Effekt (nur LK)
- Weiterer Einfluss des Induktiven Effekts
- Einfluss auf die Lage der Zweit-Substituenten am Benzol (nur LK)
- Einfluss auf die Säurestärke eines Moleküls (Säuren mit einem elektronenanziehenden Substituenten spalten das Protons leichter ab, elektronenschiebendende Substituenten führen hingegen zu einer geringen Säurestärke (+I-Effekt)
Regioselektivität bei der elektrophilen Addition
Additionen von Verbindungen des Typs H–X bringen in der Regel mehrere Produkte hervor. Es entstehen Produktgemische. Allerdings sind die prozentualen Anteile meist deutlich verschieden:
Die beiden in Frage kommenden Kohlenstoffe des Ausgangsstoffes (=Edukt) unterschieden sich durch ihre Substituenten. Eines trägt nur Wasserstoffe, das andere keinen Wasserstoff. Stattdessen ist es mit zwei Kohlenstoffen verbunden.
Man erkennt sofort, dass das Proton des H–Cl das weniger substituierte Kohlenstoffatom Angriff und an diesem gebunden wird. Ursache ist der Induktive Effekt[2] der Kohlenstoffatome, die sozusagen (sehr minimal) Elektronen schiebend die Kernladung des angegriffenen Kohlenstoffs erhöhen.
Regel von Markovnikov
Alkene, die ähnlich durch unsymmetrische Stoffe (z.B. H-Cl, H-F, H-Br. H-OH, Alkohole usw.) substituiert werden, liefern bei der Addition Produktgemische. Dabei wird das Produkt bevorzugt entstehen, bei dem sich der elektrophilere Teil (z.B. das Halogenion) des angreifenden Stoffes an dem Kohlenstoff, das die meisten Wasserstoff-Atome besitzt, anlagert.
Aber was ist die Ursache?
Der Grund ist, dass das Elektrophil an die Doppelbindung so addiert, dass das stabilere Carbenium-Ion als Übergangszustand gebildet wird. Denn dieser Übergangszustand ist sehr instabil. Durch den I-Effekt wird es stabilisiert.
- Zusatzinformationen
Induktiver Effekt Markownikow-Regel
Versuche zur Löslichkeit organischer Stoffe
Gesetzmäßigkeiten bei Lösungsvorgängen.
Erstelle eine Tabelle nach folgendem Muster und vergleiche die Löslichkeit der folgenden Stoffe in den verschiedenen Lösungsmitteln. Achte bei den organischen Lösungsmitteln darauf, die RG nicht mehr als ca. 2cm hoch zu füllen (und dann logischerweise nur wenig Lösungsstoffe zu verwenden!)
Notiere das Lösungsvermögen mit (+; +/- ; -) in der Tabelle
| Kochsalz | Schwefel | (Hart)paraffin | Wasser | Spiritus | Benzin | Pflanzenöl | Kunststoff | |
| Wasser | x | |||||||
|---|---|---|---|---|---|---|---|---|
| Spiritus | x | |||||||
| Benzin | x |
- Erkläre mit Hilfe von Zeichnungen die Regeln zu den Gesetzmäßigkeiten bei Lösungsvorgängen.
- Ist Spiritus eher polar oder apolar? Erkläre mit einer Zeichnung.
2. Bestimmen des Charakters - hydrophil oder lipophil?
In ein Reagenzglas gibt man eine winzige Menge (1 Korn!) des Farbstoffes Sudanrot und füllt mit ca. 5ml Wasser auf. Nach dem Beobachten gibt man eine halb so große Menge Benzin hinzu und schüttelt.
- Was ist zu beobachten? Wie kann die Beobachtung erklärt werden?
- Warum spricht man von 2 Phasen?
- Mit Methylenblau macht man die gegenteilige Beobachtung. Erkläre
- Gibt man Sudanrot und Methylenblau gemeinsam mit Wasser und Benzin in ein Reaktionsgefäß, so lässt sich ein Vorgang beobachten. Erkläre.
3. Löslichkeit von Gasen
Etwas Universalindikator (oder Lackmus) wird in ein Becherglas mit (wenig!) Wasser gegeben. Nun wird solange Kohlenstoffdioxid zugefügt, bis ein Farbumschlag auftritt.
- Erkläre die Hintergründe.
- Wie schätzt Du die Eigenschaften von Kohlenstoffdioxid bezüglich seiner Wasserlöslichkeit ein?
- Nenne die Alltagsanwendung zu diesem Versuch
- Welche Beobachtung aus dem Tierreich zeigt uns, dass sich auch Sauerstoff in Wasser löst?
- Zusatzaufgaben
- Vervollständige: Organische Stoffe sind meist ________________ (bzw. ________________), d.h. sie lösen sich nicht in _____________ auf, sondern in ______________ Stoffen, wie Benzin. ________________ Stoffe hingegen, wie z.B. Wasser oder Salze, sind ________________und lösen sich gut in wässrigen (also ________________) Lösungsmitteln.
- Warum ist Spiritus ein gutes Lösungsmittel für Nikotin verschmierte Möbel?
- Flecken mit Verschmierungen der Fahrradkette sollte man nicht versuchen in der Waschmaschine zu reinigen, sondern eher mit Fleckenwasser direkt entfernen. a) Was ist Fleckenwasser? b) Welchen Nachteil hätte das Waschen in der Maschine?
- ↑ bei komplexen Verfahren können zusätzliche Wasserstoffe natürlich später an die Doppelbindungen addiert werden
- ↑ Der Induktive Effekt (I-Effekt), der sowohl als +I-Effekt (=elektronenschiebend) als auch als -I-Effekt (=elektronenziehend) auftritt, wird durch funktionelle Gruppen oder auch einzelne Atome ausgelöst.
Reaktionsmechanismen
Hat die Konzentration der Edukte einen Einfluss auf den Reaktionsmechanismus?
Versuch: Reaktion von Ethanol mit Schwefelsäure
Nach der anfänglichen Protonierung des Ethanols entsteht das Ethyloxoniumion
- Ethyloxoniumion → Reaktion mit Hydrogensulfation
Nun gibt es drei Möglichkeiten:
Schwefelsäure-mono-Ethylester → Reaktion mit unprotonischen Alkoholmolekülen | ||
Diethylether | ||
Ethen → Monomolekulare Eliminierung: Reaktion wird durch die Zunahme der Teilchen bevorzugt: Entropie |
Übersicht über die drei Reaktionsmechanismen der organischen Chemie
In der OC gibt es im Grunde drei Reaktionsmechanismen (sowie die Umlagerung), die alle weiter unterteilt werden können (doch das kommt erst auf einer der folgenden Seiten):
a) Substitution: An der Kohlenstoffkette „sitzende“ Atome oder funktionelle Gruppen werden ausgetauscht bzw. ersetzt
b) Addition: Ein Angriff an Mehrfachbindungen führt zum öffnen der Mehrfachbindung und zu einer Addition von Atomen oder Molekülen. Man sagt auch, die Kohlenstoffkette wird dadurch weiter mit Atomen (Substituenten) gesättigt.
- Ethen und Brom reagieren zu 1,2-Dibromethan
- Formaldehyd und Bromwasserstoff reagieren zu 1-Brom-Methanol
- Beachte
- die Addition ist nur an ungesättigten Kohlenwasserstoffen möglich.
- oft liegt die Besonderheit der Regioselektivität vor.
c) Eliminierung: Substituenten werden entfernt, eines der bindenden Elektronenpaare bildet eine neue Mehrfachbindung.
- Ein Alkohol reagiert säurekatalysiert zu einem Alken und Wasser
d) Umlagerung (nur LK): innerhalb des Moleküls werden Atome oder Atomgruppen verschoben. Das Kohlenstoffgerüst verändert sich.

Zusatzinformationen: Umlagerung
Unterschiede der Reaktionsmechanismen
Die Unterteilung werden bei den ersten beiden Mechanismen nach dem zuerst angreifenden Teilchen vorgenommen. Zu Beginn von Reaktionen in der OC werden in der Regel Atombindungen gespalten. Dies kann auf zwei Arten geschehen:
- homolytische Spaltung:
- Radikale mit ungepaarten Elektronen entstehen.
- heterolytische Spaltung:
- Ionen entstehen
Die so gebildeten Teilchen können also ein geladenes Teilchen oder ein Radikal sein:
- a) Angriff durch Ionen oder zumindest schwach positivierte bzw. negativierte Teilchen
Ist das angreifende Teilchen durch eine heterolytische Spaltung entstanden und positiviert, so greift es elektrophil (also Elektronen liebend) an. Negative Teilchen werden eher von den Protonen im Kern der Kohlenstoffatome angezogen. Man spricht daher von einem nukleophilen Angriff.
Weiterhin kann auch eine Radikal angreifen → radikalische Reaktionen
- b) Angriff durch ein Radikal
Durch homolytischen Bindungstrennung entstehen so genannte Radikale, welche ein ungepaartes Außenelektron und somit keine Edelgaskonfiguration haben. Diese Teilchen sind dennoch ungeladen, aber sehr reaktiv.
Radikalische Substitution
Wiederholung: ![]() Organische Chemie für Schüler/ Eigenschaften und Reaktionen von Kohlenwasserstoffen#Halogenierung
Organische Chemie für Schüler/ Eigenschaften und Reaktionen von Kohlenwasserstoffen#Halogenierung
Nukleophile Substitution
Eine für Alkohole typische Reaktion ist die Substitution.
Sie läuft in zwei Schritten ab, einer vorherigen Protonierung und der anschließenden Substitution.
- Protonierung durch das Proton der angreifenden Säure (nur bei Hydroxidsubstituenten nötig)
- Angriff des Nucleophils (z.B. negatives Halogenion)
- Erste Möglichkeit SN1
- Erst Abspaltung der Abgangsgruppe, dann Angriff des Nukleophils
Das angreifende nukleophile Teilchen muss mindestens ein freies Elektronenpaar besitzen.
- Zweite Möglichkeit SN2
- Gleichzeitige Abspaltung und rückseitiger Angriff des Halogenions
Läuft die Abspaltung und der Angriff gleichzeitig ab, also beide Teilchen eine Einfluss auf die Reaktion haben, so spricht man auch von einer bimolekularen Substitution.
Nach dem SN2-Mechanismus läuft beispielsweise die Bromierung von Ethanol ab. Merke: Die Bindung zum abgehenden Substituenten wird in dem Maße gelöst, wie sich die Bindung zum Nucleophil bildet.
Nach welchem Mechanismus eine Reaktion abläuft, ist vor allem von der Molekülstruktur der Ausgangsstoffe sowie vom Lösungsmittel abhängig.
- Zusatzinformationen
- Aufgaben
- 2-Brom-2-methylpropan reagiert mit Wasser.
- a) Formuliere für beide Möglichkeiten den Reaktionsmechanismus
- b) Benenne das Produkt
- c) Welchen Mechanismus hältst Du für wahrscheinlicher?
- Lösung
Mechanismus Aufgabe 1 (SN1: Erst Abspaltung des Bromids, dann Angriff des Wassers)
Kann man anhand der Energiediagramme SN1 und SN2 unterscheiden?

-
SN1: Bildung eines evtl. isolierbaren Zwischenproduktes
-
SN2: Bildung eines nicht isolierbaren Übergangszustandes
Was ist Nucleophilie?
Nukleophile Substitutionen sind sehr häufig in der organischen Chemie anzutreffen, was auch auf die große Vielfalt der vorhandenen Reaktionspartner zurückzuführen ist. Dabei findet immer der Angriff des Nukleophils und das Verlassen der Abgangsgruppe als Reaktion statt. Man spricht in diesem Fall sogar von einem „Wettbewerb“.
Gute nucleophile Angriffe gehen von Anionen aus, welche in der Regel als Lithium-, Natrium- oder Kaliumsalze der Reaktion zugefügt werden. Aber auch partialnegative Atome können angreifen - sie sind dementsprechend schwächer nukleophil.
- Gute Nucleophile
-
Alkoholate, z.B.: H3C–CH2–O–
-
Säurereste der Carbonsäuren (Carboxylat-Anionen)
-
Thioloate (Thio = Schwefel)
-
Cyanide
Wie man am letzten Beispiel sieht, können auch Moleküle mit freien Elektronenpaaren als Nukleophile reagieren. Zu den potentiellen Reaktionspartnern gehört somit also auch Wasser oder Amine (H3C–NH2).
- Zusatzinformationen
Da Nukleophile immer freie Elektronenpaare haben sind sie somit auch immer Basen und können so auch Eliminierungsreaktionen auslösen.
Eliminierung
V1: 2-Propanol wird mit Schwefelsäure erhitzt.
B1: Es entweicht ein farbloses Gas.
V2: Das Gas wird durch gelbes Bromwasser geleitet
B2: Das Bromwasser entfärbt sich
S2: Es muss ein Alken/ Alkin vorgelegen haben, da an diesen durch Bromwasser eine Addition stattfindet
S: Es ist Propen entstanden, welches Bromwasser entfärbt (durch eine sofortige Addition des Broms an die Doppelbindung). Aus dem Propanol hat sich Wasser abgespalten.
Mechanismus der Eliminierung
Der Mechanismus ist relativ leicht verständlich. Die Schwefelsäure löst die Reaktion aus, da sie eine recht hohe Affinität zu Laugen (also Hydroxiden (=OH)-) hat. Die alkoholische Hydroxidgruppe trennt sich mit dem Elektronenpaar vom Alkan und hinterlässt einen dreibindigen Kohlenstoff. Das Molekül gleicht es dadurch aus, dass es ein Wasserstoffatom ohne Elektron (also ein Proton) abspaltet und diese Bindung dazu nutzt, eine Doppelbindung zu bilden. So haben wieder alle Kohlenstoffe in der Verbindung Edelgaskonfiguration. Ein Alken ist entstanden.
Das freigewordene Proton sowie ein Proton der Schwefelsäure verbinden sich gemeinsam mit der Hydroxidgruppe. Sie bilden H3O+. Aus der Schwefelsäure wurde der Säurerest Hydrogensulfat.
Tipp: Bei heterolytischen Spaltungen bekommt in der Regel der elektronegativere Bindungspartner das Bindungselektronenpaar zugeteilt.
LK
E1: Voraussetzung für die Eliminierung ist die Bildung eines Carboniumions

E2: Bei diesem Mechanismus erfolgt das Abspalten eines Protons (mit Hilfe einer Base) und das Abspalten des Bromid-Ions gleichzeitig. Das heißt es entsteht kein Carbokation als Zwischenprodukt. Die E2 hingegen ist ein konzertierter Prozess. Es werden keine Carbeniumionen gebildet.

Eliminierung und nucleophile Substitution sind Konkurrenzreaktionen.
Zusatzinformationen: Eliminierungsreaktion
Was entsteht eigentlich für eine Säure?
Wenn Schwefelsäure mit Wasser in Verbindung kommt, dissoziiert sie in die Ionen H+ und (HSO4)- bzw. 2H+ und (SO4)2- .
Das ist so bei starken Säuren. Ist also das Produkt wasserfrei, dann entsteht Schwefelsäure. Liegt immer auch etwas Wasser vor, durch den Alkohol, der nicht rein war oder durch Wasser bei den Ausgangsstoffen oder weil sogar Wasser entsteht, dann bilden sich die Ionen.
Elektrophile Addition (AE)
Dieses Kapitel bzw. dieser Abschnitt wird durch intensive Zusammenarbeit sicher schnell besser. Der Hauptautor freut sich über jeden, der mitmacht. Versucht dich vielleicht nur an den schon vorgegebenen Inhalt und an die Form (bei Listen z.B.) anzupassen. Aber wenn etwas nicht passt, rührt sich der Hauptautor bestimmt. Kaputtmachen kannst du nicht viel – also sei mutig. Danke.
Beispiele für Additionsreaktionen
- Hydrierung: Addition von Wasserstoffionen
- Halogenierung: Addition von Halogenenionen
- Hydrohalogenierung: Addition von HF, HCl, HBr oder HI
- Hydratisierung: Addition von Wasser
- Sulfonierung: Addition von Schwefeltrioxid (SO3)2-
- Addition von Schwefelsäure
Bromierung von Ethen
V: Man leitet Ethen durch einen Standzylinder mit Brom
B: Entfärbung des Broms
S: Es fand eine elektrophile Addition statt.
Mechanismus der elektrophilen Addition
1) Kurzzeitige Dipole führen zur heterolytischen Spaltung (in Br+ und Br-). Das positivere Bromatom wird von der Doppelbindung angezogen, bildet einen positiv geladenen Übergangskomplex (=Carbeniumion) und bildet schließlich eine Bindung mit dem negativen Bromion.

Besonderheit Regioselektivität!(nicht in diesem Bsp.) Das Bromidion greift das weniger stark substituierte C-Atom an, da dies eine niedrigere Elektronendichte aufweist.
→ Induktiver EffektDurch unterschiedliche Elektronegativitätswerte von Atomen in einer Atombindung wird diese polarisiert und der elektronegativere Partner zieht die Elektronen zu sich heran. Es sinkt entsprechend am anderen Atomen die Elektronendichte.
- -I-Effekt:Ein Atom oder Molekülteil entzieht einem benachbarten C-Atom Elektronendichte Nucleophile greifen besser an. (z.B. Halogenatome, Sauerstoffatome)
- +I-Effekt:Ein Atom oder Molekülteil erhöht die Elektronendichte an einem benachbarten C-Atom Elektrophile greifen besser an. (z.B. Alkylgruppen)
- Zusatzinformationen
Der π-Komplex
Pi-Komplex (π-Komplex) ist eine Bezeichnung aus dem Fachjargon der Komplexchemie. Es bezeichnet Koordinationsverbindungen, die häufig nur als instabile Zwischenstufen auftreten. Sie basieren auf Wechselwirkungen zwischen Elektronenpaaren einer Doppelbindung und freien Koordinationsstellen, oft denen eines Übergangsmetalls.
Besonderheit Regioselektivität
Regioselektivität bei der elektrophilen Addition
Regel von Markovnikov
Die Markovnikov-Regel (1869) besagt, dass die Anlagerung von Halogenwasserstoffen an asymmetrische Alkene immer an den Kohlenstoff mit dem meisten Wasserstoff erfolgt.
Beispiel einer Reaktion nach Markovnikov:
- Reaktion von Propen mit Salzsäure zu 2-Chlorpropan
Da die Bildung des Produkts der Markovnikov-Regel folgte, nennt man es "Markovnikov-Produkt".
Aber was ist die Ursache für ungleiche Verteilungen zwischen beiden Produkten?
Zwei Carbokationen - Carbiniumion und Carboniumion
Kettenlänge und die daraus folgende Geschwindigkeit der elektrophilen Addition

|
Je länger die Alkylkette, desto größer ist der +I-Effekt des Alkyl-Restes
|
Wiederholungsaufgaben
- Formulieren sie den Mechanismus der Reaktion von 1-Butanol mit Iodwasserstoffsäure
- Welche Mechanismen sind für Alkohole typisch?
- Der Entzug von Wasser aus einer Verbindung wird auch Dehydratisierung genannt. Formuliere eine solche Reaktion für 2-Propanol und benenne den Reaktionsmechanismus
- Vergleiche die Anzahl der theoretisch möglichen Produkte der Reaktion von HCl mit Butan bzw. 1-Buten
- Benenne die folgenden Verbindungen und vergleiche anschließend die jeweilige Reaktion mit Brom hinsichtlich der Produkte und der Reaktionsgeschwindigkeit:
- Ethen + Brom
- Propen + Brom
- Buten + Brom
- tert-Butyl-Ethen + Brom
- Gibt man 1-Brompentan mit einer Lauge zusammen bilden sich zwei Phasen (=Schichten)
- a) Erklären sie dieses Phänomen mit einer allgemeingültigen Regel
- b) Beim Erhitzen dieses Gemisches verschwinden diese beiden Schichten (bei gleich bleibendem Volumen). Auch nach dem Abkühlen bleibt nur eine Phase übrig. Erstelle die Reaktionsgleichung und benenne die Produkte.
- Welche Produkte bilden sich beim Erhitzen von 2-Methyl-2-Hydroxy-Pentan mit konzentrierter Schwefelsäure?
- In einigen Fällen bilden sich bei organischen Reaktionen als Zwischenprodukte so genannte Carbeniumionen mit drei Substituenten. Welche Gründe sprechen dafür, dass sie a) überhaupt isoliert werden können und b) nicht sehr lange existent sind?
- Zeichne alle möglichen Produkte der Dehydratisierung von 3-Methyl-3-Hexanol. Welches der möglichen Isomere wird prozentual am meisten entstehen?
- Formuliere die Reaktionsgleichungen von:
- a) NaOH + CH3-CH2-CH2-Br
- b) NH3 + CH3-CH2Br
Alkohole
Alkohol
Allgemeine Informationen
- Neben Nikotin ist Alkohol die die häufigste Droge in Deutschland. (Volksdroge Nummer 1)
- Er ist fast immer präsent: beim Essen, Fernsehen, Arbeiten, Reisen, Unterhalten, Sport.
- Das Wort „Alkohol“ kommt aus dem Arabischen „Ar-kul“ = das Feinste
- seit 3000 Jahren bekannt
- Umgangssprachlich wird unter Alkohol vor allem der Alkohol Ethanol (früher Äthanol oder noch früher Ethylalkohol, auch Weingeist) verstanden. Es gibt natürlich zu jedem Alkan entsprechende Alkohole und mehrfach Alkohole! Zur Unterscheidung werden sie deshalb auch Alkanole genannt.
- In Deutschland starben im Jahr 2005 ca.17.000 Menschen durch Alkohol-Missbrauch. 2005 starben alleine in Russland 36000 Menschen nur durch Alkoholvergiftungen!
- Konsum: In Deutschland wurden 2001 pro Kopf getrunken (120 L Bier, 16 L Wein, 6 L Spirituosen, 6 L Sekt. Das entspricht 153 L alkoholischer Getränke im Vergleich zu 507 L nicht alkoholische Getränke) also einer Menge von 10,5 Litern reinem Alkohol pro Einwohner.
Wirkung
- Berauschende Wirkung
- Die Blutgefäße werden geweitet, → stärkere Durchblutung (rote Haut, Nase)
- Hautporen öffnen sich → trotz anfänglichem Wärmegefühl erfolgt ein Wärmeverlust für den Körper → Gefahr der Unterkühlung
- Die Niere scheidet Alkohol mit viel Wasser aus
- hoher Wasserverlust durch Urinausscheidung
- Nachdurst
- Alkohol enthaltende Getränke (mit Angabe des Alkoholgehaltes in Volumenprozent)
- reifer Kefir: bis ca. 3%
- Leichtbiere: 1-2,5%
- Vollbiere: ca 3-5%
- Starkbiere: 6-12%
- Weine: 10-15%
- Met: 5-14%
- Liköre: 15-75%, oft ~ 30%
- Spirituosen: ca. 30-96%
- Im Handel ist noch eine andere Form erhältlich
Spiritus enthält meist 96% Ethanol und 4% Wasser sowie einen geringen Anteil an Vergällungsmittel, welcher den Alkohol ungenießbar machen soll. Solcher vergällter Alkohol ist für Menschen ungenießbar und somit von der Genussmittelsteuer befreit.
Spiritus ist ein gutes Reinigungsmittel für Fette, Lösungsmittel und beispielsweise Nikotinflecken
Chemische Hintergründe, Aufnahme und Abbau
Die Aufnahme des Alkohols (=Resorption) in das Blut findet vor allem in Magen und Darm statt. Sie dauert (je nach Getränk) ca. 30-60 Minuten. Ein geringer Teil des Alkohols wird allerdings schon von der Mundschleimhaut aufgenommen, so dass der aufgenommene Alkohol direkt ins Blut gelangt und sich dann über den gesamten Körper verteilt. Er wirkt dabei besonders auf Gehirn und Nervenzellen.
Alkohol wird mit dem Blut in die Leber transportiert, welche ihn dann letztlich durch enzymatische Vorgänge abbaut (pro Stunde und pro Kilogramm Körpergewicht ca. 0,1g Alkohol)[1].
Da vor allem bei destillierten (gebrannten) Produkten die volle Wirkung des Getränks erst nach ca. 30min einsetzt, kann diese erst nach einiger Zeit eingeschätzt werden. Keinesfalls schon sofort nach dem Genuss! Dies bemerken vor allem sehr junge Jugendliche, die erstmalig Alkohol trinken, anfänglich keine Wirkung spüren und dann weiter trinken. Nach einer halben Stunde haben sie dann schon zu große Mengen getrunken → Alkoholvergiftung.
Die Alkoholaufnahme wird bei die Durchblutung steigernden Faktoren beschleunigt:
- Sport
- Wärme (Irish Coffee, Grog)
- Zucker (Likör)
- Kohlenstoffdioxid (als Kohlensäure z.B. im Sekt)
Die Alkoholaufnahme wird durch Fette verlangsamt:
- Dies führt aber nicht zu einer niedrigeren Aufnahme des Alkohols insgesamt, sondern nur zu einer zeitlichen Streckung.
Abbau des Ethanols im menschlichen Körper
Der Alkoholabbau wird im Körper durch gespeicherte Leberenzyme durchgeführt.
- Ethanol → Ethanal → Ethansäure (=Essigsäure) → Kohlenstoffdioxid
- Das Zwischenprodukt Ethanal sowie ein oft einhergehender kurzzeitiger Magnesiummangel (bedingt durch eine hohe Affinität von Ethanol zu Magnesium) ist für den so genannten Kater verantwortlich.
- Der Abbau des Ethanols wird durch Zucker gehemmt → Bei süßen Getränken bleibt der Alkohol länger im Blut und seine Abbauprodukt Ethanal entsteht später und über ein längeren Zeitraum. Die Konsequenz ist eine verstärkte Katerwirkung bei süßen alkoholischen Getränken wie Bowlen und Likören.
- Der Abbau des Ethanols im menschliche Körper ist bei Frauen und Männern nicht genau gleich. minimale genetische Unterschiede beschleunigen den Alkoholabbau bei Männern im Magen durch die „gastrische“ Alkoholdehydrogenase. Männer bauen Alkohol also etwas schneller ab als Frauen. Hinzu kommt eine bei Männern in der Regel größere Körpermasse, welche den Abbau ebenfalls beschleunigt.
- Durch häufigen Alkoholkonsum wird die Abbaurate übrigens nicht erhöht. Der Trainingseffekt bei regelmäßigem Konsum ist vor allem auf eine Vorratsspeicherung von Alkoholdehydrogenase in der Leber sowie eine Gewöhnung des Nervensystems an die höhere Ethanolmenge zurückzuführen.
- Berechnung des Alkoholspiegels: C Alkohol (in Promille ‰) = [Getrunkener Alkohol (in Gramm)] : [Körpergewicht (in Kilogramm) ] · 0,7
Alkoholkonsum
| ‰ (Promille) | Wirkung |
|---|---|
| 0,2 | Entspannung, Wärmegefühl, Persönlichkeitsveränderungen wie z.B.: Fröhlichkeit, Gesprächigkeit, Risikobereitschaft, Volkstänze oder sich sonst irgendwie zum Deppen machen *g* |
| 0,5 | Aggressionen steigen, Leistungsfähigkeit sinkt, Selbstüberschätzung nimmt zu („klar kann ich noch fahren“) |
| 0,6 | Sehleistung bereits vermindert (leichter Tunnelblick), Konzentrationsverlust |
| 0,8 | Sehfähigkeit lässt um etwa 30% nach, Reaktionszeit ist etwa 35% länger. Motorik bereits grob |
| 1-2 | Rausch, Sprach- und Gleichgewichtsstörungen, Verlust der Selbstkontrolle, Absterben von Gehirnzellen (reicht deutlich aus für ein „nie wieder Alkohol“ am nächsten Morgen *g*) |
| 2-3 | Betäubungsstadium: Erinnerungslücken (Filmriss), Verwirrung, Erbrechen, vermehrte Anzeichen von Atemschwierigkeiten |
| 3-4 | komplette Desorientierung/Halluzinationen, Lähmungen, Tiefschlaf |
| 4-5 | Atmungsmuskel wird gelähmt → Tod |
- (Leichte) Symptome des Dauerkonsums
Magenschleimhautentzündungen, Magengeschwüre, Verminderung der Sexualfunktion, geringere körperliche Leistungsfähigkeit, teilweise Verwahrlosung
- (Schwerwiegende) Symptome des Dauerkonsums
Abhängigkeit (bereits ab 2 Bier pro Tag möglich!), erst Fettleber, später Schrumpfleber (=Leberzirrhose), Organbeeinträchtigungen, Organversagen, soziale Ausgrenzung.
- Nebenwirkungen
- Alkohol ist ein gutes Lösungsmittel für viele Substanzen. Dies ist problematisch, wenn Alkohol zusammen mit Medikamenten oder anderen Drogen konsumiert wird. Vielfältige Wechselwirkungen, welche die Einzelwirkungen noch verstärken sind üblich.
- jedes Jahr sterben tausende weltweit durch den für Menschen giftigen Alkohol Methanol, welcher bei der Herstellung von Ethanol als Nebenprodukt entstehen kann. (2006 alleine 300 in Russland)
- Aufgaben
- Berechne, wie viel Promille Alkohol Du schon bei einem Glas der folgenden Alkoholika im Blut hättest:
- Ein Glas Bier (0,3l) enthält 14,4g reinen Alkohol
- Ein Glas Wein (0,2l) enthält 19,2g reinen Alkohol
- Ein Glas Schnaps (Korn) (0,02l) enthält 7,8g reinen Alkohol
- Warum reagieren Männer und Frauen unterschiedlich stark auf dieselbe Menge Alkohol? Ergibt sich dadurch eine Konsequenz für eine mögliche Sucht Gefährdung?
- 10% aller Verkehrsunfälle werden durch Alkohol verursacht. Jährlich sterben dadurch mehr als 2000 Menschen[2], mehr als 55000 werden dabei verletzt. Ein Viertel der „Alkoholtäter“ sind nach Polizeiangaben jünger als 25 Jahre. Versuche Ursachen und Erklärungen für diese Aussagen zu finden.
- Zusatzinformationen
Ethanolherstellung
Herstellung durch alkoholische Gärung
Alkohol entsteht u.a. bei der Vergärung von zucker- oder stärkehaltigen Substanzen durch Hefen oder Bakterien. So entsteht zum Beispiel Wein aus Weintrauben oder Bier (aus Malz und Hopfen).
Durch Destillation kann der Alkoholgehalt noch erhöht bzw. fast reiner Alkohol (=Azeotropes Gemisch) gewonnen werden. Solche Getränke bezeichnet man als Spirituosen (z.B. Whiskey, Kognak, Schnaps, Wodka oder Rum). Liköre sind Spirituosen, denen Zucker und Aromen zugesetzt werden.
Als Nebenprodukt kann beim Destillieren Methanol (früher auch Methylalkohol genannt) entstehen. Dieser ist so giftig, dass jedes Jahr Hunderte daran sterben!
Zur Wiederholung aus der Biologie: Hefezellen betreiben Zellatmung, aber bei Sauerstoffmangel (=anaerobe Bedingungen) führen sie die alkoholische Gärung durch!
- C6H12O6 → 2 C2H5OH + 2 CO2 + E
Die maximal erzielbare Alkoholkonzentration durch Gärung beträgt dabei ca. 15% Vol., danach sterben die Hefepilze.
Herstellung durch elektrophile Addition von Wasser an ein Alken
(1) Kurzzeitige Dipole beim Wasser sorgen für eine Anziehung zwischen dem elektropositiveren Wasserstoff des Wassers und der Doppelbindung.
(2) Als Folge wird das Wasser heterolytisch gespalten (in H+ und OH-). Das Wasserstoffion wird von der Doppelbindung angezogen
(3) Es bildet sich ein Übergangskomplex von H+ mit dem Ethen. Die Doppelbindung wird dabei aufgespalten.
(4) Es bildet sich eine feste Bindung zwischen Kohlenstoff und Wasserstoff, da die Doppelbindung sozusagen wie ein Fensterladen „aufklappt“. In der Folge ist das obere C-Atom allerdings nur noch dreibindig und somit positiv geladen (=Carbeniumion).
(5) Die positive Ladung des Carbeniumions sorgt für eine Anziehung und eine anschließende Verbindung mit dem negativen Hydroxid. Es ist Ethanol entstanden.
Nomenklatur
- Alkohole heißen Alkanole, Endung –ol (bzw. bei komplexen Verbindungen auch „-Hydroxy“)
- Kohlenstoffkette, die die funktionelle Gruppe trägt gibt der Verbindung den Namen
- Alkyl- und Halogensubstituenten werden dem Namen vorangestellt
-
1-Brom-2-Butanol
-
1-Brom-4-Butanol
-
3-Brom-2-Methyl-1-Propanol
-
3-Brom-2-methylbutan-2-ol
- Man kann die Alkohole in primäre, sekundäre und tertiäre Alkohole unterscheiden, indem man je nach Anzahl der Kohlenstoffnachbarn des OH-Gruppe gebundenen C-Atoms zählt.
- Primärer Alkohol: Das C-Atom mit der OH-Gruppe hat ein weiteres C-Atom gebunden (z.B. bei Ethanol) - siehe auch Beispiel 1.
- Sekundärer Alkohol: Das C-Atom mit der OH-Gruppe hat zwei weitere C-Atome gebunden - siehe auch Beispiel 2.
- Tertiärer Alkohol: Das C-Atom mit der OH-Gruppe hat drei weitere C-Atome gebunden (Beispiel 3)
Auch eine Unterscheidung nach der Anzahl in einem Molekül vorhanden OH-Gruppen in einwertige, zweiwertige, dreiwertige usw... (also mehrwertige) Alkohole ist möglich. Mehrwertige Alkohole enthalten also zwei oder mehr OH-Gruppen.
Eigenschaften primärer Alkanole
Alkanole leiten sich von den Alkanen ab und sind gesättigte Alkohole mit der Summenformel CnH2n+1+OH. Ein entständiges Wasserstoffatom der Kohlenstoffkette ist durch eine Hydroxidgruppe ersetzt. Früher wurden diese Alkohole auch mit der Endung „-yl“ versehen, z.b. Methylalkohol scheint als Wort unausrottbar in den Köpfen der Menschheit fest gebrannt - die korrekte Bezeichnung lautet Methanol).
Die Isomerie kommt hier genauso vor, wie bei den Alkanen auch, so dass es mit steigender Kettenlänge und Verzweigung der Kohlenstoffkette eine zunehmende Anzahl an Isomeren gibt.
Schmelz- und Siedepunkte liegen höher als die der entsprechenden Alkane - Ursache ist die Hydroxidgruppe, welche Wasserstoffbrückenbindungen (WBBs) ausbildet. So kommt es zu einem stärkerem Zusammenhalt der Moleküle. Dadurch ist mehr Energie notwendig, sie aus ihrem jeweiligem Verband zu lösen und in den nächsten Aggregatzustand zu überführen.
| Systematischer Name | Summenformel | Dichte (g/cm3) | Siedepunkt (°C) | Siedepunkt der entsprechenden Alkane (°C) |
|---|---|---|---|---|
| Methanol | CH3OH | 0,812 | 66 | -161 |
| Ethanol | C2H5OH | 0,806 | 78 | -88 |
| Propanol | C3H7OH | 0,817 | 96,5 | -42 |
| Iso-Propanol | C3H7OH | 0,789 | 81 | -0,5 |
| Butanol | C4H9OH | 0,823 | 116,7 | 36 |
| Pentanol | C5H11OH | 0,829 | 137 | 69 |
| Hexanol | C6H13OH | 0,833 | 157 | 98 |
| Heptanol | C7H15OH | 0,836 | 175 | 126 |
| Octanol | C8H17OH | 0,839 | 194,5 | 151 |
| Nonanol | C9H19OH | 0,842 | 213 | 174 |
Typische Vertreter der Alkohole
| Typische primäre Alkohole | |
|---|---|
| Methanol | H3C-OH
|
| Ethanol |
|
| Eigenschaften sekundärer Alkanole | |
| Isopropanol (2-Propanol) |
|
| Eigenschaften zwei- und mehrwertiger Alkohole | |
| Auch als Polyalkohole bezeichnet, enthalten mehrwertige Alkohole mehrere Hydoxidgruppen. | |
| Ethandiol (Glykol) | zweiwertiger Alkohol (Glycol)
|
| Glycerin (Propantriol) | dreiwertiger Alkohol (Glycerin)
|
| Pentaerythrit(ol) |
|
| Eigenschaften aromatischer Alkohole | |
| Phenol (Hydroxybenzol) |
|
Die funktionelle Gruppe der Alkohole -OH
Funktionelle Gruppen sind Gruppen, welche an Alkanen und Alkenen eine besondere Funktion erfüllen. Sie sind in der Regel stark für den Charakter der jeweiligen Verbindung bestimmend. So ist die funktionelle Gruppe der Alkanole, die auch Alkohole genannt werden die Hydroxylgruppe (OH) die funktionelle Gruppe. Sie kennzeichnet die Gruppe der Alkohole, welche auch Alkanole genannt wird.
- Beispiele für natürlich vorkommende Alkohole
- Ethanol ist ein Produkt der alkoholischen Gärung von Hefen.
- Glycerin findet man in Membranfetten, Fetten und Ölen. Es gibt auch einen Frosch, der im Winter eingefroren in Eis überlebt, da er Glycerin im Blut hat, welches vor Kristallisation schützt.
- Zucker, Stärke und Zellulose enthalten viele Hydroxylgruppen
- Verwendung
- Kurzkettige Alkohole sind meist recht passable Lösungsmittel für wasserlösliche also hydrophile Stoffe. Aber auch unpolare (lipophile) Stoffe lassen sich teilweise Lösen. Alkohol hat als Lösungsmittel damit eine Doppelrolle.
- als Genussmittel
- Rohstoff der Kosmetik und Parfumindustrie
- Lösungsmittel und Ausgangstoff für Synthesen in der chemischen Industrie
- zur Sprengstoffherstellung bei der Synthese von Nitroglyzerin
- Alkohole sind Ausgangstoffe für die Produktion von Alkansäuren durch Oxidation
Der Vorgang ist umkehrbar, d.h., durch eine Reduktion von Ethansäure lässt sich Ethanol herstellen.
- Zusatzinformationen
Oxidierbarkeit von Alkoholen (Unterschied primäre und sekundäre Alkohole)
Primäre Alkohole werden über das entsprechende Aldehyd zur Carbonsäure oxidiert.
Sekundäre Alkohole können nur zum Keton oxidiert werden. Eine weitere Oxidation ist mangels Angriffspunkt für einen zweiten Sauerstoff nicht möglich. Nur die endgültige Oxidation zum Kohlenstoffdioxid ist immer möglich.
Tertiäre Alkohole nur zum Kohlenstoffdioxid oxidiert werden.
→ Unterscheidbarkeit isomerer Alkohole
Dem Alkohol verwand: Die Ether
Ether sind Verbindungen, welche nach dem Schema R1 − O − R2 aufgebaut sind (R steht dabei für beliebige Alkylreste). Sie kommen sowohl in der Natur (z.B. die Aromastoffe Anisol und Vanillin), als auch in künstlich hergestellten Formen vor. Der bekannteste Ether ist der Di-Ethyl-Ether:
Diethylether ist eine gutes Lösungsmittel für apolare Stoffe und hat einen scharfen Geruch nach Desinfektionsmittel, bzw. Zahnarzt. Es wurde früher als Narkosemittel benutzt.
- Halbstrukturformel Diethylether: CH3-CH2-O-CH2-CH3
- Smp. / Sdp.: -116,3°C, 34,4°C
Die Bindungsverhältnisse der Ether sind denen der Alkohole ähnlich - auch wenn es formal keine Alkohole sind!
Es gibt sowohl unverzweigte, verzweigte und zyklische Ether.
Die meisten Ether sind nicht sehr reaktionsfreudig.
Säurekatalysierte Kondensation von zwei Alkoholen zu Ether
Durch Säure können zwei Alkoholmoleküle zu einem Ether kondensieren:

- R = beliebiger Alkylrest
- wird bei der Herstellung nur eine Alkoholart verwendet, entstehen symetrische Ether
Zusatzinformationen:
Wiederholungsaufgaben zu Alkoholen
- Gibt es eine eindeutige homologe Reihe der Alkohole?
- Wie kann man Ethanol gewinnen. Nenne 2 Möglichkeiten.
- Zeichne alle und benenne (nur 10) Alkohole mit 5 Kohlenstoffatomen. Ordne anschließend in primäre, sekundäre und tertiäre Alkohole.
- Welche Alkohole sind dabei Spiegelbildisomere?
- Je höher die Anzahl an Kohlenstoffatomen, desto viskoser werden sie. Erkläre.
- Warum haben Alkohole im Vergleich zu Alkanen gleicher Kettelänge höhere Smp. und Sdp.?
- Zeichne 1-Propanol und Propantriol und treffe Aussagen bezüglich der Smp., Sdp. und der Viskosität.
- Ordne die folgenden Substanzen hinsichtlich ihrer Löslichkeit in Wasser: CO2, Methan, Methanol, Pentanol. Begründe.
- Ordne die folgenden Substanzen hinsichtlich ihres Vermögens Kochsalz zu lösen: Methanol, Wasser, Benzin, Tetrachlormethan.
- Ordne nach zunehmenden Siedepunkten: 1,2 Propandiol, Glycerin, 2 Propanol, Propan.
- Vergleiche Ethanol und (Diethyl-)Ether (H3C-CH2-O-CH2-CH3) hinsichtlich ihrer Siedepunkte.
- Formuliere die Reaktionsgleichung des Ethanolations mit Wasser. Was wird man beobachten können, wenn man Universalindikator hinzufügt.
- In Gegenwart von Natronlauge reagiert Ethanol nicht als Säure. Bei der Reaktion mit Natrium gibt es allerdings schon ein Proton ab. Ist Ethanol damit doch eine Säure?
Weblinks
- http://wiki.zum.de/Lernzirkel_Alkohole - Lehrmaterial zur Gruppenarbeit
- ↑ Das Enzym Alkoholdehydrogenase baut Ethanol zu Ethanal (H3C-CHO) ab, das weiter zu Ethansäure (=Essigsäure) oxidiert wird. Die Ethansäure wird über den Citratzyklus und die Atmungskette in allen Zellen des Körpers unter Energiegewinnung zu CO2 veratmet.
- ↑ Insgesamt ca. 60 000 Alkoholtote in Deutschland
Carbonsäuren
Carbonsäuren (organische Säuren)
V1: In konzentrierte Essigsäure werden zwei Elektroden aus Graphit gegeben und ein Stromkreis mit Ampèremeter angeschlossen (5-10 Volt Wechselspannung). Die so gemessene Stromstärke gibt Auskunft über die Leitfähigkeit der Lösung.
Nach dem ersten Messen der Leitfähigkeit wird kontinuierlich Wasser hinzu gegeben und die Stromstärke beobachtet.
| B | S: |
| 1. Essigsäure zeigt keinerlei messbare Leitfähigkeit | → In Lösungen können nur Ionen die Elektronen von einer Elektrode zur anderen transportieren.
Liegt keine Leitfähigkeit vor, ist der Stromkreis nicht geschlossen. Also sind demzufolge keine Ionen in der Lösung vorhanden |
| 2. Je mehr Wasser hinzu gegeben wird, desto höher steigt die Leitfähigkeit. Sie übertrifft sogar den Wert der Leitfähigkeit von reinem Wasser. | → Durch die Zugabe von Wasser müssen sich Ionen gebildet haben. |
Wo kommen diese Ionen her?
- Essigsäure (Ethansäure) + Wasser → Essigsäuresäureanion + Oxoniumion
- Wichtige Zusatzinformationen
- Die Heterolyse ist ebenfalls eine heterolytische Spaltung. Eine solche Aufspaltung von Verbindungen in Wasser in ihre Ionen wird auch Dissoziation genannt.
- Eine Dissoziation muss nicht vollständig sein. Bei Essigsäure dissoziiert ca. jedes 100. Molekül (→ pH ca. 5, da die Konzentration an H3O+ = 10-5 mol/l (statt 10-7 mol/l bei Wasser)
- Da H+ keine Elektronen hat und nur ein Proton (und kein Neutron!), wird es unter Chemikern auch als Proton bezeichnet!
- Wichtig: Säure und saure Eigenschaften sind keine unveränderbaren Stoffeigenschaften (wie z.B. der Siedepunkt). Essigsäure beispielsweise ist also erst in Verbindung mit Wasser eine Säure! Sauer kann folglich keine Stoffeigenschaft sein, sondern erst das Ergebnis einer Reaktion, bei der Oxoniumionen[1] entstehen.
- Umgangssprachlich sagen Chemiker oft, dass das H+ - Ion die Säureeigenschaften ausmacht. Als Erklärung für viele Modelle ist dies auch mehr als ausreichend. Genau genommen ist es aber immer das Oxoniumion (H3O+), welches die sauren Eigenschaften ausmacht.
- Zum Nachdenken: Du kennst jetzt die beiden Grundtypen chemischer Reaktionen:
a) Redoxreaktionen: Elektronen (e-) werden übertragen b) Säure-Base-Reaktionen: Protonen (p+) werden übertragen
- Zusatzinformationen
Eisessig
Carbonsäuren haben durch ihren Aufbau und vor allem durch das Ausbilden starker WBBs hohe Schmelz- und Siedepunkte (im Vergleich zu Alkanen und Alkoholen gleicher Kettenlänge).
Besonders deutlich wird dies beim Gefrieren von Essigsäure.
V: Essigsäure wird in den Kühlschrank gestellt (evtl. ein gelegtes RG).
B: Essigsäure ist nach wenigen Minuten gefroren.
S: Der Schmelzpunkt von Essigsäure liegt oberhalb der Temperatur des Kühlschranks.
Kühlschränke kühlen meist im Bereich von 4-6°C, der Schmelzpunkt von wasserfreier, konzentrierter Essigsäure liegt bei 16,2°C.
Versuche mit Carbonsäuren
V1. pH- Messung von Natriumacetat in wenig Wasser
B: Natriumacetat zeigt mit Wasser einen leicht alkalischen pH-Wert von ca. 9.
S: Nicht alle Salze reagieren mit Wasser neutral! Es gibt mit Wasser reagierende saure und alkalisch reagierende Salze. Natriumacetat ist ein Salz der Essigsäure. Es reagiert als Base, indem es ein Proton des Wassers aufnimmt. Dabei bilden sich Hydroxidionen (OH–), welche für den gemessenen pH-Wert verantwortlich sind.
- Natriumacetat + Wasser → Essigsäure + Hydroxid + Natriumion

V2. Essigsäure unverdünnt und verdünnt in Calciumcarbonat (Kalk) geben. Das Gas kann mit einem Stopfen und einem Glasrohr in Kalkwasser geleitet werden.
B:
- Bei verdünnter Essigsäure ist die saure Wirkung viel stärker!
- Gasentwicklung (wenn Kalkwasser verwendet wurde, trübt es sich milchig)
S: Man würde erst mal erwarten, dass bei einer konzentrierten Säure die Reaktion heftiger ist.
Zur Reaktion muss man aber wissen, dass durch Wasserzugabe eine weitere (zweite!) Säure (das Oxoniumion H3O+) entsteht und diese als starke Säure viel stärker sauer als Essigsäure ist.
- Essigsäure + Calciumcarbonat + Wasser → Essigsäuresäureanion + Oxoniumion + Kohlenstoffdioxid
Kalkwasser trübt sich aufgrund des Kohlenstoffdioxids. Kalkwasser ist ein Kohlenstoffdioxidnachweis. Das entstandene Kohlenstoffdioxid lässt die Flüssigkeit aufschäumen.
Informationen zu Carbonsäuren
Carbonsäuren kommen in der Natur häufig vor. Sie dienen z.B. als Abwehrstoff (Ameisensäure), Fruchtsäuren, kommen in Schweiß vor und bilden Ölen, Fette, Harze und Wachse. Man findet sie ebenfalls in Geruchsstoffen und in natürlichen Aromen. Essigsäure beispielsweise entsteht durch die Oxidation von Aldehyden oder primären Alkoholen:
Stehenlassen von Wein in einer geöffneten Flasche:
Alkohol → Oxidation zum Aldehyd → Oxidation zur Carbonsäure
Ethanol → Ethanal → Ethansäure (= Essigsäure)
Da die Carbonsäuren sich von den Alkanen ableiten und als funktionelle Gruppe die Carboxyl-Gruppe enthalten (Achtung: das C-Atom der Carboxygruppe wird mitgezählt!), kann man entsprechend auch hier eine homologe Reihung aufstellen[2]:
| Name | Trivialname | Säurerestanion | Formel |
|---|---|---|---|
| Methansäure | Ameisensäure | Formiat | H–COOH |
| Ethansäure | Essigsäure | Acetat | H3C–COOH |
| Propansäure | Propionsäure | Propionat | H3C–CH2–COOH |
| Butansäure | Buttersäure | Butyrat | H3C–(CH2)2–COOH |
-
Propionsäure (im Schweiß enthalten)
-
Buttersäure (in ranziger Butter enthalten)
- Zusatzinformationen
Carbonsäuren Ameisensäure Essigsäure Propionsäure Buttersäure
Weitere Typen von Carbonsäuren
Gesättigte und ungesättigte Fettsäuren:
Höhere, (langkettige) Carbonsäuren werden Fettsäuren genannt. Carbonsäuren mit mindestens 4 Kohlenstoffatomen können von Lebewesen zum Aufbau von Fetten verwendet werden. Man nennt sie deshalb und auch wegen ihrer Unlöslichkeit in Wasser Fettsäuren. Die meisten Fettsäuren bei Säugetieren tragen 15-16 Kohlenstoffatome.
Enthalten sie keine Doppelbindungen, nennt man sie gesättigte Fettsäuren. Sie sind eher in tierischen Fetten zu finden. Ungesättigte Fettsäuren enthalten entsprechend eine oder mehrere Mehrfachbindungen. Sie sind für die menschliche Ernährung sehr wertvoll, da sie Vorstufen zu Vitaminen darstellen können. Man findet sie eher in Pflanzen.
Beispiele für Fettsäuren:

Palmitinsäure (Anion: Palmitat) H3C–(CH2)14–COOH(=C15H31COOH) Palmitinsäure und Stearinsäure sind die mit am häufigsten vorkommenden Bestandteile pflanzlicher Fettsäuren. Palmöl besteht z.B. zu 45% daraus.

Stearinsäure (Anion: Stearat) H3C–(CH2)16–COOH(= C17H35COOH)schwache, feste (!) Säure, bildet weiße Blättchen, Geruch nach altem Fett, nicht wasserlöslich, Verwendung als Zusatzstoff in Waschmitteln. Das Natriumsalz Natriumstearat wird als Reinigungsmittel verwendet, auch Zusatzstoff der Lebensmittelindustrie, manchmal Wachsbestandteil. Stearinsäure ist Ausgangsstoff zur Herstellung von Kernseife und somit in vielen Waschmitteln vorhanden. Ebenfalls für Kosmetika verwendet (Cremes).
Als gesättigte Fettsäure v.a. im Schweinefett (14%), im Rinderfett (20%), und auch in der Milch (im Milchfett 13%) zu finden. Stearinsäure

Ölsäure (Anion: Oleat) H3C–(CH2)15–COOH(=C17H33COOH)Bestandteil der entsprechenden Triglyceride sehr vielen natürlichen Ölen und Fetten vor, z.B.: Olivenöl (55-80 %), Traubenkernöl (15-20 %) und Erdnussöl.

- Weitere wichtige Alkansäuren
Ameisensäure, Arachinsäure, Essigsäure, Propionsäure, Buttersäure, Valeriansäure, Capronsäure, Önanthsäure, Caprylsäure, Pelargonsäure, Caprinsäure, Undecansäure, Laurinsäure, Tridecansäure, Myristinsäure, Pentadecansäure, Palmitinsäure, Margarinsäure, Stearinsäure
Dicarbonsäuren und Polycarbonsäuren
Carbonsäuren können eine oder mehrere Carboxylgruppen enthalten. Carbonsäuren mit zwei Carboxylgruppen werden Dicarbonsäuren genannt.
Die Vorsilben Mono-, Di- oder Tri- geben dabei natürlich die Anzahl der Carboxyl-Gruppen an
- Beispiele
- Oxalsäure Oxalat HOOC–COOH (=Ethandisäure; kommt in Sauerklee vor)
- Malonsäure Malonat HOOC–CH2–COOH
- Bernsteinsäure Succinat HOOC–CH2–CH2–COOH
Hydroxycarbonsäuren
Ihr Kennzeichen ist, dass sie zusätzlich zur Carboxylgruppe noch eine Hydroxygruppe (OH) haben.
z.B. Milchsäure (Hydroxypropansäure), Citronensäure, Weinsäure.
-
Äpfelsäure
-
Citronensäure
Cyclische Carbonsäuren
Ist die funktionelle Carboxygruppe mit einem aromatischem Ring verbunden (oft Benzol) nennt man sie Cyclo-Carbonsäuren. Der Benzolring kann zusätzlich noch mit einer OH-Gruppe verbunden sein (aromatischen Hydroxycarbonsäuren).
-
Benzolcarbonsäure (Benzoesäure)
-
Phthalsäure (aromatische Dicarbonsäure)
-
Acetylsalicylsäure (enthalten in Aspirin)
-
Ascorbinsäure (bekannt als Vitamin C)
Übersicht über die wichtigsten Carbonsäuren und ihre Salze
Wenn eine Carbonsäure dissoziiert, dann entsteht ein Proton und ein Säurerestanion. Das Säurerestanion kann sich aufgrund seiner negativen Ladung leicht mit einem positiv Metallkation (z.B. Na+ oder K+) vereinigen und so ein Salz bilden. Diese Salze heißen entsprechend den anorganischen Salzen nach dem Metallnamen und dem Säurerestionnamen.
| Säure | Säurerestion | Beispielsalz |
|---|---|---|
| Oxalsäure | Oxalat | Natriumoxalat |
| Buttersäure | Butyrat | Natriumbutyrate |
| Malonsäure | Malonat | Natriummalonat |
| Bernsteinsäure | Succinat | Natriumsuccinat |
| Palmitinsäure | Palmitat | Natriumpalmitat |
| Stearinsäure | Stearat | Natriumstearat |
| Milchsäure | Lactat | Natriumlactat |
| Citronensäure | Citrat | Natriumcitrat |
| Weinsäure | Tartrat | Natriumtartrat |
| Äpfelsäure | Malat | Natriummalat |
| Ascorbinsäure | Ascorbat | Natriumascorbat |
Allgemeine Eigenschaften der Carbonsäuren

Kurzkettige Carbonsäuren (bis C8) sind bei Raumtemperatur flüssig. Durch ihre hohe Polarität lösen sie sich gut in Wasser. Dabei geben sie ihr Proton ab (Dissoziation in Ionen). Aber nur kurzkettige Carbonsäuren (bis C4) sind wasserlöslich, da bei ihnen der polare Anteil der Carboxylgruppe gegenüber der unpolaren Kohlenstoffkette überwiegt. Wasserstoffbrückenbindungen erhöhen die Wasserlöslichkeit. Je länger nun die apolare Kohlenstoffkette wird, desto mehr nehmen deren apolare Eigenschaften zu, die Van-der-Waals-Kräfte steigen und die Siedepunkte nehmen auch zu. So ist die Pentansäure kaum noch in Wasser löslich.
Die feste Ausbildung von Wasserstoffbrückenbindungen und die daraus resultierenden hohen Siedepunkte sind die Konsequenz. In der Reihe Alkane → Aldehyde → Alkohole → Carbonsäuren haben sie die höchsten Siedepunkte bei gleicher Kohlenstoffkettenlänge.
→ kürzerkettige Carbonsäuren (bis Octansäure) sind wasserlöslich und bei Raumtemperatur flüssig
Carbonsäuren längerer Kohlenwasserstoffketten sind dickflüssiger und ihr apolarer Charakter nimmt deutlich zu. Fettsäuren sind kaum noch wasserlöslich.
Verstärkt wird dieser Effekt durch die bei Carbonsäuren typische Bildung von „Dimeren“ - dabei handelt es sich um eine Form von Assoziation zwischen jeweils zwei Molekülen:

Zwei Moleküle bilden einen lockeren Verband (ein Dimer) - dieser zusätzliche Zusammenhalt erhöht Schmelz und Siedepunkte der Carbonsäuren. So liegen Smp. und Sdp. wesentlich höher als die der vergleichbaren Alkohole.
Die O-H Bindung ist durch den -I Effekt des anderen (hier: oberen) Sauerstoffatoms stark polarisiert.
Entsprechend wie die Wasserlöslichkeit nimmt auch die Dissoziation und die damit verbundene Säurestärke mit zunehmender Kettenlänge der Carbonsäuren ab.
- Vergleich[3]
- pKs-WertAmeisensäure = 3,65
- pKs-WertEssigsäure = 4,65
Generell ist die Säurestärke vor allem von der Elektronegativität des Atoms an welches das H-Atom gebunden ist abhängig. Ein weiterer Effekt ist die anschließende Stabilisierung des negativ geladenen Anions (Säurerests) durch Elektronen ziehende Effekte sowie durch Mesomerie der Doppelbindung:
Mesomerie: Grenzstrukturen zeigen eine Delokalisierung der Doppelbindung
Herstellung:
Carbonsäuren können durch Oxidation von Alkoholen oder Aldehyden sowie durch die Reduktion von Kohlendioxid (mit Grignard-Verbindungen) hergestellt werden.
Der Hauptanteil der Produktion geschieht allerdings durch Gärung (Essigsäureproduktion durch Gärung im sauerstoffreichen Milieu). Dies geschieht schon durch stehen lassen einer offenen Weinflasche nach wenigen Tagen.
Verwendung:
Carbonsäuren und ihrer Salze werden zu vielen Zwecken verwendet:
- Zusatzstoffe und Konservierungsstoffe in Lebensmitteln
- Herstellung von Seifen (Tensiden)
- Ausgangsstoffe sowie Zwischenprodukte für weitere organischen Synthesen u.a. - Herstellung von Riechstoffen (als Basis für Ester)
- Herstellung von Kunststoffen,
- Medikamentenherstellung
- Farbstoffherstellung
- Kunstharzherstellung
- Aufgaben
- Was versteht man unter einem korrespondierendem Säure-Base-Paar? Erstelle zur Erklärung eine beliebige Reaktionsgleichung einer Neutralisation und kennzeichne es.
- In welche Ionen dissoziiert Ameisensäure?
- Welchen Einfluss haben andere Faktoren auf die Leitfähigkeit bei Messungen von Flüssigkeiten?
- Welcher Zusammenhang besteht zwischen Ionenanzahl einer Lösung und der sich daraus ergebenden Erhöhung der Leitfähigkeit?
- Reines (destilliertes) Wasser hat auch eine leichte Leitfähigkeit. Sie lässt nach Berechnung auf eine Konzentration von ca. 10-7 mol Ionen pro mol Wasser schließen. Weißt Du welches Ion (welche Ionen) hier für die Leitfähigkeit verantwortlich sind?
- Je länger die Kohlenstoffkette einer Monocarbonsäure, desto geringer wird ihre Leitfähigkeit. Finde verschiedene Ursachen für diesen Befund!
- Was versteht man unter Mesomerie?
Formeln von einigen ausgewählten organischen Säuren
- Monocarbonsäuren
-
Ameisensäure
-
Essigsäure
- Dicarbonsäuren
-
Oxalsäure
-
Bernsteinsäure
- Hydroxycarbonsäuren
Der sechseckige Ring steht für eine zyklische Kohlenstoffverbindung mit der Formel C6H6
-
Äpfelsäure
-
Citronensäure
- Säuren mit aromatischen Ring
-
Acetylsalicylsäure
-
Ascorbinsäure
Übersicht über die organischen Säuren
Die Carbonsäuren beinhalten eine große Gruppe von organischen Säuren, die in der Natur weit verbreitet sind.
Chemische Reaktionen der Carbonsäuren
- Die bekannteste Reaktion der Carbonsäuren ist die Esterbildung aus Carbonsäure und Alkoholen. (Siehe dazu Kapitel „Ester“). Ein Sonderfall stellt dabei die Veresterung von Glycerin mit drei Fettsäuren dar. Es entstehen die zum Membranaufbau bei Menschen verwendeten Triglyceride.
- Eine weitere bekannte Reaktion ist die Substitution. Besonders Halogene lassen sich an die Kohlenstoffkette anlagern (→ Halogencarbonsäuren entstehen). Halogencarbonsäuren sind reaktiver und stärker sauer (durch den I-Effekt des Halogens) als ihre nicht halogenierten Gegenstücke. Mit Wasser reagieren die Halogencarbonsäuren wieder zurück zur Carbonsäure und dem entsprechenden Halogenwasserstoff.
Substitution einer Carbonsäure mit Chlor
- Essigsäure und Chlor reagiert zu Chloressigsäure und Chlorwasserstoff
Substituiert man halogenierte Carbonsäuren mit Ammoniak (NH3) bilden sich Amide. Bildung eines Amids aus einer Halogencarbonsäure:
- Chloressigsäure + Ammoniak → Ethansäureamid (Acetamid) + Ammoniumchlorid
Nicht zu verwechseln sind Amide (funktionelle Gruppe: CO–NR2) mit Aminosäuren (zwei funktionelle Gruppen: Aminogruppe NH2 und Carbonsäuregruppe COOH).
- Saure Reaktion der Carbonsäuren: Wie schon erwähnt spalten vor allem kürzerkettige Carbonsäuren recht leicht ihr Proton ab und reagieren unter Bildung in Wasser von H3O+ sauer. Günstig wirkt dabei die Mesomeriestabilisierung des Anions.
Beachte den Einfluss der Substituenten auf die Säurestärke:
- Substituenten mit -I-Effekt erhöhen die Säurestärke (also geringer pKs).
- Substituenten mit +I-Effekt verringern die Säurestärke (hoher pKs)
- Aufgabe
- Erkläre den Zusammenhang zwischen dem I-Effekt und der resultierenden Säurestärke mit eigenen Worten
- Wie stellt man mit den Metallen Magnesium, Calcium, Zink oder Eisen die entsprechenden Acetate her? (Welche Gemeinsamkeit haben diese Metalle?)
Stereoisomerie (=Spiegelbildisomerie)
Milchsäure ist u.a. das Produkt der Milchsäurebakterien. Diese befinden sich bei Menschen und Wirbeltieren auf der Haut und leben mit diesen in Symbiose (zum gegenseitigen Nutzen). Sie werden vom Körper u.a. über den Schweiß ernährt und scheiden als Stoffwechselendprodukt Milchsäure aus. Diese schützt uns Menschen beispielsweise vor Hautpilzen und anderen (schädlichen) Bakterien.
Milchsäurebakterien befinden sich auch am Euter der Kuh. So gelangen sie in die Milch und nach wenigen Tagen, haben sie sich ausreichend vermehrt und soviel Milchsäure hergestellt, dass die Milch sauer wird. Bei der Herstellung von vielen Milchprodukten (z.B. der Yoghurtherstellung) macht man sich dies zunutze.
Wenn man die Milchsäure im Labor untersucht, stellt man fest, dass es zwei Isomere gibt. Da sie sich im Aufbau wie Spiegelbilder zueinander verhalten, nennt man diese auch Spiegelbildisomere (oder Stereoisomere)
- Linksdrehende Milchsäure = L(+)-Milchsäure (lat.: laevus = links)
- Rechtsdrehende Milchsäure = D(-)-Milchsäure (lat.: dexter = rechts)
Stellt man die Kohlenstoffkette von oben nach unten dar (nach Fischer), so erkennt man, dass der Wasserstoff und das Hydroxid sowohl einmal links oder rechts liegen können. Durch einfaches Drehen der Verbindung kann man beide Formen nicht ineinander überführen.
Dies tritt immer dann auf, wenn vier unterschiedliche Substituenten an einem Kohlenstoffatom sitzen. Solche Substanzen, die sich spiegelbildlich zueinander verhalten, nennt man auch Enantiomere (griechisch: enantios = entgegengesetzt).
(Man nennt solche Verbindungen auch chirale Verbindungen (nicht deckungsgleich), das Phänomen auch Chiralität. In allen Fällen liegt ein zentrales asymmetrisches Kohlenstoffatom vor.)
Die bekanntesten chiralen Verbindungen sind Zucker, einige Carbonsäuren wie Milchsäure und Weinsäure sowie die Aminosäuren.
Chirale Verbindungen lassen sich durch polarisiertes Licht unterschieden, deshalb spricht man in diesem Zusammenhang auch oft von optischer Aktivität.
Ein Gemisch aus links- und rechtsdrehenden Substanzen wird auch Racemat genannt.
- Zusatzinformationen
Es gibt Stereoisomere, die keine Enantiomere sind. Man bezeichnet diese als Diastereomere.
- Aufgaben
- Zeichne beide Isomere der Weinsäure
Fischer Projektion
Die Fischer-Projektion erlaubt das Darstellen der optisch aktiven Substanzen auf dem Papier.
- Regeln
- Die Kohlenstoffkette wird senkrecht angeordnet, so dass das C-Atom mit der höchsten Oxidationszahl oben ist.
- die restlichen Substituenten werden horizontal angeordnet
- Gruppen, die waagrecht am C* sitzen zeigen nach vorne aus der Tafelebene. Gruppen, die senkrecht am C* sitzen zeigen nach hinten aus der Tafelebene
- Das Enantiomer wird nach der Stellung der funktionellen Gruppe am C* bezeichnet.- steht die funktionelle Gruppe nach links → L-Form - steht funktionelle Gruppe steht nach rechts → D-Form
- Zusatzinformationen
Fischer-Projektion Hermann Emil Fischer
- ↑ Oxonium wurde früher auch Hydroniumion genannt
- ↑ Viele Carbonsäuren sind unter ihrem Trivialnamen eher bekannt.
- ↑ Zur Erklärung pKs- Wert (=Säurestärke) siehe pKs-Wert
Ester
Versuche mit Estern
Darstellung von Essigsäureethylester

In einem Rundkolben werden 50 ml Ethanol und 50 ml Essigsäure sowie 10 ml konz. Schwefelsäure ca. 5 min. erhitzt.
Das Erhitzen geschieht aus Sicherheitsgründen mit einer elektrischen Heizplatte. Wenn die Reaktion abgelaufen und abgekühlt ist wird alles aus dem Kolben in ein Becherglas mit Wasser erhitzt
B: Ein flüssiges Produkt entsteht
S: Es entsteht Essigsäureethylester, welcher sehr flüchtig ist.
Zusatzversuch: in Essigsäureethylester kann leicht Styropor aufgelöst werden.
Veresterungen im RG
a) Ester aus anorganischen Säuren
V: 1 ml Ethanol + 3 ml konz. Schwefelsäure werden über der Brennerflamme erwärmt.
S: Es bildet sich Ethylschwefelsäureester, welcher einen typischen Estergeruch hat.
b) Birnenaroma
V: Zu 3 ml Pentanol werden 3 ml halbkonzentrierter Essigsäure und wenige Tropfen konz. Schwefelsäure zugefügt. Dann wird alles kurz erwärmt. (Wegen der brennbaren Dämpfe nicht erhitzen!)
S: Es entsteht Essigsäurepentylester (naturidentischer Aromastoff), welcher ein Hauptbestandteil von Birnenaroma ist.
c) Nelkenaroma
V: Zu einer Spatelspitze Benzoesäure wird wenig (ca. 3 ml) Ethanol sowie wenige Tropfen Schwefelsäure gegeben.
S: Es ist der naturidentische Aromastoff Benzoesäureethylester entstanden
Was sind Ester?

Ester sind Verbindungen mit der funktionellen Gruppe R1-COOR2 (R1=Rest 1; R2=Rest 2)
Ester entstehen bei der Reaktion einer organischen Säure[1] und eines Alkohols unter Abspaltung von Wasser (Kondensation). Die umgekehrte Reaktion, Spaltung eines Esters in Alkohol und Säure unter Anlagerung von Wasser, nennt man Hydrolyse.
Das Wort Ester ist aus der Bezeichnung Essig-Äther (Ethylacetat) abgeleitet, einer wenig wasserlöslichen Substanz mit einer ähnlich betäubenden Wirkung wie Diethylether.
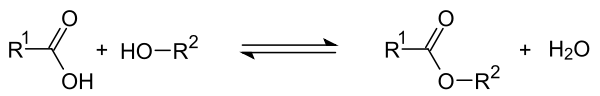
Diese Reaktion wird Veresterung genannt. Sie entspricht einer nukleophilen Addition[2]. Veresterungen laufen nicht einfach durch, solange bis kein Ausgangsstoff vorliegt (wie z.B. es bei einer Verbrennung der Fall wäre). Es findet auch eine Rückreaktion der Produkte zu den Ausgangsstoffen statt. Nach einiger Zeit stellt sich also innerhalb des Reaktionsgemisches ein chemisches Gleichgewicht ein, und es liegen alle vier Stoffe gleichzeitig vor. Da Seife durch Hydrolyse von Fettsäure-Glycerinestern hergestellt wird, spricht man bei der Rückreaktion der Veresterung auch von „Verseifung“ bzw. Verseifungsreaktion.
Benannt werden Ester
a) entweder korrekt nach den beiden Komponenten und der funktionellen Gruppe: Ethylethanoat
b) nach dem Prinzip „Rest des Alkohols“ mit -yl (also hier Ethyl) + Grundkörper der Säure (= Ethan) und der Endung „oat“ gebildet.
c) manchmal auch durch Trivialnamen, die sich in der Regel aus den Trivialnamen der Salze der Säuren ableiten: Methylacetat (=Essigsäuremethylester), Ethylbutyrat (=Buttersäureethylester) u.a.
Seife wird durch Kochen von Fetten mit Laugen hersgestellt. Die Hydroxid-Ionen der Lauge neutralisieren die Wasserstoff-Ionen der Fettsäuren und verschieben so das Gleichgewicht stark in Richtung Hydrolyse, so daß die Esterspaltung fast vollständig verläuft.
Verseifung
- R1-COO-R2 + H2O + NaOH → R1-COO-Na+ + R2-OH
Eigenschaften & Verwendung
- Carbonsäureester zeigen nur eine geringe Polarität (durch die beiden Sauerstoffatome). Sie lösen sich demzufolge nur minimal in Wasser, was auf der Ausbildung von Wasserstoffbrücken-Bindungen zwischen dem Lösungsmittel Wasser und dem herausragenden, freien Sauerstoffatom beruht.
- Je länger die Kohlenstoffketten werden, desto geringer ist die Wasserlöslichkeit, da die Wirkung des polaren Sauerstoffs im Verhältnis zu den unpolaren Kohlenstoffketten immer kleiner wird. Zum Vergleich: In 1 l Wasser lösen sich 250 g Essigsäuremethylester, nur noch 80 g Essigsäureethylester und weniger als 1 g Essigsäurebutylester. Alle längerkettigen Ester sind also hydrophob.
- In Wasser reagieren sie neutral.
- Ihre Siedepunkte liegen im Vergleich zu Alkoholen bzw. Carbonsäuren gleicher Kettenlänge durch nur geringe Ausbildung von Wasserstoffbrücken-Bindungen wesentlich niedriger.
- Die Ester der kurzkettigen Carbonsäuren (C1 bis C5) sind stark flüchtig und haben einen angenehmen, fruchtigen Geruch. Man findet Ester als Aromastoffe in der ganzen Natur, unter anderem auch in reifen Früchten (Fruchtester)[3].
- Ester finden vielfältige Verwendung in der Lebensmittelindustrie (u. a. als Aromastoffe in Fastfood, Limonaden, Weingummi, Bonbons).
- Ester werden auch als Lösungsmittel verwendet, z. B. in Farben und Lacken.
- Wachse sind Ester aus langkettigen Säuren (z. B. Palmitinsäure) und langkettigen Alkoholen (>26 C-Atome). So besteht Bienenwachs hauptsächlich aus Estern des Myrcylalkohols (C30H61OH).
- Fette und fette Öle sind Mehrfachester langkettiger Carbonsäuren mit Glycerin.
- Andere Mehrfachester sind zum Beispiel die als Bestandteile der Zellmembran vorkommenden, aus Glycerin gebildeten Phosphoglyceride.
- Seifen sind Alkalisalze höherer Fettsäuren. Ihre wässrigen Lösungen haben durch das gleichzeitige Vorliegen eines polaren Endes (Carbonsäure-Anion) und eines unpolaren Endes (lange Kohlenwasserstoffkette) eine waschaktive Wirkung. Solche Stoffe werden auch Tenside genannt.
- Lactone sind cyclische Ester mit nur einem Ausgangsmolekül, welches beide an der Esterbildung beteiligten funktionellen Gruppen zugleich enthält, die Säuregruppe und die Alkoholgruppe.
- Aus Dicarbonsäuren und Mehrfachalkoholen lassen sich lange Ester-Kettenmoleküle darstellen: Polyester. Der bekannteste Polyester ist der Kunststoff PET (PolyEthylenTerephtalat).
- Auch Zellulose, welche ja aus Glucosemolekülen aufgebaut ist und sehr viele Hydroxylgruppen trägt, kann mit Essigsäure verestert werden. Celluloseacetat findet u. a. Verwendung als Textilfaser ("Acetatseide"). Das Polymergerüst wird hier aber, anders als bei den Polyestern, nicht durch die Veresterung gebildet, es liegt schon beim Ausgangsmaterial Zellulose vor.
- Ein anderer Celluloseester ist Cellulosenitrat (RCO-NO2), das vor der Entwicklung der modernen Kunststoffe von großer Bedeutung war, z. B. als Bestandteil des Zelluloids (für photographische Filme, Brillengestelle etc.). Auch heute findet es noch Verwendung, z. B. für Tischtennisbälle oder hochwertige Füllhalter.
- Man verwendet Ester in Weichmachern für Kunststoffe wie PVC. (Geruch nach neuem Auto!)
- Medizinische Verwendung: Ethylnitrit (CH3-CH2-O-N=O) wirkt harntreibend und fiebersenkend, Amylnitrit ((CH3)2CHCH2CH2-O-N=O) wirkt krampflösend bei Asthma und bei epileptischen Anfällen.
- Verwendung einiger Phosphorsäureester als Insektizid (z.B. Parathion (C10H14NO5PS) und Dichlorvos (C4H7Cl2O4P).
- Einige Ester werden auch als militärische Kampfstoffe verwendet. Tabun (Dimethylphosphoramidocyansäureethylester, C5H11N2O2P2), Soman (Methylphosphonofluoric acid, C7H16FO2P), Sarin (Methylfluorphosphonsäureisopropylester, CH3P(O)(F)OCH(CH3)2)
- Glycerintrinitrat (O2NO-H2C-CH(ONO2)-CH2-ONO2), auch bekannt als Nitroglyzerin, wird als Sprengstoff verwendet.
- Im Saft von Wolfsmilchgewächsen sind Phorbolester enthalten. Sie lösen neben ausgeprägten Hautverätzungen und starken Magenbeschwerden auch bösartige Tumore aus, da sie das Enzym Proteinkinase C stimuliert, welches das Wachstumsverhalten von Krebszellen modifiziert.
Zusatzinformationen:
- Eine weitere (technisch bedeutende) Reaktion ist die Umesterung. Hierbei wird bei einem Ester der Alkoholrest durch einen anderen ausgetauscht. So wird z. B. Rapsöl mit Methanol umgeestert, so dass aus einem Fettsäure-Glycerinester-Molekül mit drei langkettigen Fettsäuren drei Moleküle Fettsäure-Methylester erzeugt werden: Biodiesel
- Ester
Beispiele für Veresterungen
Einfache Ester
| + |
→ 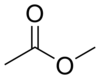 |
+
| |
 |
+ |
→  |
+
|
| + |
→  |
+
|
Komplexe Ester: Fette und Öle
Komplexe Ester: Polyester:
- ↑ es gibt auch Ester von anorganischen Säuren (z.B. Phosphorsäure, Borsäure).
- ↑ zuerst greift der Alkohol an das partial positive Kohlenstoffatom der Carboxylgruppe an.
- ↑ Beispiele: Ethansäure-2-butylester (CH3COOC4H9) riecht nach Apfel, Ethansäure-2-methyl-1-propylester (CH3COOCOOC3H7) riecht nach Banane, Ethansäure-2-hexylester (CH3COOC6H13) riecht nach Erdbeere.
Aromatische Kohlenwasserstoffe
Die Aromaten sind eine besondere Verbindungsklasse der OC. Ihr Hauptmerkmal ist ihre besondere Bindungsstruktur (konjugierten Doppelbindungen[1]) in Ringform. Sie unterscheiden sich in der Regel deutlich in ihren Eigenschaften von den kettenförmigen Kohlenwasserstoffverbindungen (auch aliphatische Kohlenwasserstoffe genannt).
Geschichte
Der erste Aromat den man entdeckte war das Benzol (C6H6). Von seinem Geruch stammt die Bezeichnung Aromat (Griechisch: Aroma = Duft).
Bald fand man auch Stoffe mit ähnlichen Eigenschaften, welche einen anderen Aufbau zeigten. Man bemerkte schnell, dass diese Verbindungen trotz Doppelbindungen nicht leicht zu Additionsreaktionen zu bewegen waren.
Gemeinsame Eigenschaften
- mehrfach ungesättigt (also mehrere Doppelbindungen)
- zyklische, fast immer planare (!) Moleküle
- alle Atome des Rings sind sp2-hybridisiert (nur LK)
- gegenüber der Addition an der Doppelbindung relativ reaktionsträge
- neigen stattdessen zu einer Substitution an der Doppelbindung
- das Bindungssystem aus konjugieren Doppelbindungen ist für eine hohe Stabilität des Moleküls verantwortlich. Um die Bindungen aufzubrechen ist vergleichsweise viel Energie notwendig.
Hückel-Regel: Die Zahl der delokalisierten π-Elektronen muss bei Aromaten der Formel 4n+2 entsprechen. (z.B. 2, 6, 10, 14)
Der bekannteste Vertreter der Aromaten ist das Benzol. (nach der Hückel-Regel besitzt Benzol 6π-Elektronen.)Reaktionen von Aromaten
Additionsreaktionen am Aromaten sind aufgrund der festen Bindungsstruktur schwierig. Aromaten reagieren überwiegend nach dem Mechanismus der elektrophilen aromatischen Substitution (z.B. Sulfonierung, Nitrierung). Nucleophile aromatische Substitution sind selten.
Aromaten lassen sich mehrfach substituieren. Dafür gelten dann besondere Regeln.
Zusatzinformationen
Benzol (C6H6)
Eigenschaften und aromatische Struktur
Das erste Mal, dass Wissenschaftler auf Benzol aufmerksam wurden, war beim Prozess des Entgasens von Steinkohle. Dies führte man im 19. Jahrhundert durch, um beispielsweise Gas für Straßenlaternen zu gewinnen. Als Nebenprodukt fand man eine bei Raumtemperatur farblose Flüssigkeit, welche besonders aromatisch riecht. Liebig nannte sie Benzol.
Benzol ist besonders dünnflüssig und verbrennt an der Luft mit oranger und rußender Flamme. Schon bei Raumtemperatur ist es allerdings leicht flüchtig, so das seine Dämpfe besonders feuergefährlich sind.
Den Umgang damit sollte man meiden, da es über die Haut in den Körper eindringt und über die Lunge eingeatmet wird und im Körper als Zellgift wirkt. Es schädigt das Knochenmark, die Leber und die Nieren sowie die Bildung der roten Blutkörperchen. Schon geringe Mengen führen beim Einatmen zu Schwindel und Erbrechen. Bewusstlosigkeit schließt sich an.
Des Weiteren ist es krebserregend (cancerogen).
Benzol ist apolar und mischt sich demzufolge nicht mit Wasser. Es ist aufgrund seines apolaren Charakters ein gutes Lösungsmittel für apolare Stoffe und somit ein wichtiger Rohstoff der chemischen Industrie.
Vorkommen und Verwendung
Man findet Benzol in Steinkohle und Erdöl. Bei der Verbrennung von Benzin und Diesel wird es demzufolge freigesetzt. Auch wenn der Anteil im Laufe der letzten Jahre in Treibstoffen stetig abgenommen hat, so werden immer noch 75% der Emissionen durch den Verkehr freigesetzt.
Es entsteht ebenfalls beim Verbrennen von Tabak. (10-100 µg pro Zigarette). Auch durch Vulkanausbrüchen oder unvollständigen Bränden (Schwelbränden) kann es entstehen und freigesetzt werden.
Lebensmittel die an Tankstellen verkauft werden waren in den letzten Jahren immer wieder durch verhältnismäßig hohe Benzolbelastung aufgefallen. Mittlerweile sind die Tankstellenmärkte mit Überdruck gefüllt, damit beim Öffnen der Tür nur Luft nach draußen gelangt und keine Benzingase hinein.
Viele Substanzen, welche Benzol enthielten sind heutzutage in Deutschland verboten. (Außer den Treibstoffen, wo es z.B. die Klopffestigkeit von Benzin erhöht (Zumischung 1 bis 5%!). In den USA ist diese Praxis schon lange verboten.
In der chemischen Industrie wird es als Lösungsmittel sowie als Ausgangsstoff für die Synthese vieler organischer Verbindungen (v.a. von Kunststoffen) verwendet (z.B. Anilin, Styrol, Nylon, Synthesekautschuk, Kunststoffe, waschaktive Stoffe, Insektizide, Farbstoffe usw.)
Mehrringige Aromaten sowie Aromaten mit Substituenten werden ebenfalls aus Benzol gewonnen (Phenol, Nitrobenzol, Anilin, Chlorbenzol, Hydrochinon und Pikrinsäure usw.).
Geschichte der Strukturaufklärung des Benzols
Der Chemiker August Kekulé (1829-1896) erforscht die Strukturformel des Benzols. Er hatte an dieser harten Nuss lange zu „knabbern“. Aus den Messungen von 1845 des Chemikers Mitscherlich wusste er, dass alle 6 Atome des Benzols gleichwertig sind und das es reaktionsträge wie ein Alkan ist. Additionen, wie die der Alkene waren bei Benzol aber nicht möglich.
Mit den üblichen Alkanformeln war aber dieses Rätsel nicht zu lösen, bis ihm eines Nachts im Traum die Verbindung in Form einer Schlange erschien, die den eigenen Schwanz erfasste. So schloss Kekulé auf die Ringstruktur des Benzols.
Mesomerie
Kekulé nahm an, dass die Doppelbindungen des Benzols nicht einen festen Platz haben, sondern dass sie vielmehr ständig den Platz wechseln.
-
Strukturformel Benzol
-
mesomere Grenzformeln
Heute weiß man, dass die 6 pz-Elektronen des Benzols über und unter der Ebene des Rings liegen. Es bildet sich ein ringförmiges π-Elektronensystem aus, welches durch die ständige Bewegung der Elektronen delokalisiert ist.
Durch diese Form der Mesomerie ist das Benzolmolekül energetisch besonders stabilisiert und demzufolge reaktionsträge. Deshalb ist ein wichtiges Erkennungsmerkmal der Aromaten auch das Ausbleiben der Additionsreaktion mit beispielsweise Bromwasserstoffsäure oder Bromwasser.
Ein Beweis für die Delokalisierung und die demzufolge besondere Art der Bindung sind die Bindungslängen zwischen den Kohlenstoffatomen. Eine C-C Einfachbindung ist 154pm und eine C=C Doppelbindung ist 134pm[2] lang. Beim Benzol liegt bei allen Kohlenstoffen eine Bindungslänge von 139pm vor.
Zusatzinformationen:
Mesomeriestabilisierung des Benzol

Die Senkrecht stehenden p-Orbitale (Elektronenwolken) überlappen und bilden so über und unterhalb des Benzolrings einen gemeinsamen Bereich. Dieser wird π-Orbital genannt.
Dies ist der tatsächliche Zustand der Elektronen im Benzol. Mesomere Grenzstrukturen können diese exakt Darstellung nicht liefern - vermitteln aber immerhin ein Idee davon!
- Merkmale der Bindungen
- Planarer Aufbau des gesamten Moleküls
- Die Bindungslänge zwischen allen Kohlenstoffatomen beträgt 139pm
- Jedes Kohlenstoffatom besitzt ein p-Orbital (auch sp2-Hybridisierung genannt). Die Folge ist eine Delokalisierung der Elektronen ober- und unterhalb des Rings.
Verschiedene Aromaten
a) Fünfringige Aromaten
-
Furan
-
Benzofuran
-
Isobenzofuran
-
Pyrrol
-
Indol
-
Isoindol
-
Thiophen
-
Benzothiophen
-
Benzo[c]thiophen
-
Imidazol
-
Benzimidazol
-
Purin
-
Pyrazol
-
Indazol
-
Oxazol
-
Benzoxazol
-
Isoxazol
-
Benzisoxazol
-
Thiazol
-
Benzothiazol
b) Sechsringige Aromaten
-
Benzol
-
Naphthalin
-
Anthracen
-
Pyridin
-
Chinolin
-
Isochinolin
-
Pyrazin
-
Chinoxalin
-
Acridin
-
Pyrimidin
-
Chinazolin
-
Pyridazin
-
Cinnolin
Freiarbeit Aromaten: 1. Was sind Aromaten?
- Sind Aromaten mit 3 Kohlenstoffatomen möglich?
- Zeichne Aromaten mit 6 bzw. 9 oder 10 Kohlenstoffatomen
- Zeichne in die folgenden Strukturformeln die Doppelbindungen ein und bestimmen dann, ob Aromaten vorliegen:
- Zeichne alle drei mesomeren Grenzformen für Naphthalin. C10H8
- Ist die Verbindung [10]-Annulen ein Aromat, oder nicht?
- Ist Cycloheptatrien ein Aromat?
- Kannst Du jetzt definieren, was der aromatische Zustand ist?
Zusatzinformationen: Hückel-Regel Naphthalin
Freiarbeit Aromaten: 2. Nomenklatur der Aromaten
- Zeichne: a) Benzaldehyd, b) Benzylalkohol, c) Toluol, d) Phenol e) Benzoesäure
- Zeichne: a) 1,3,5-Trimethylbenzol, b) 2,6-Dibrom-4-chlortoluol, c) Phenylcyclohexan
- Heteroaromaten sind durch Atome im Ringsystem gekennzeichnet, die nicht aus Kohlenstoff bestehen. Sind sie wirklich Aromaten?
- Bei welchen der oben genannten Aromaten gilt sie nicht?
- Entsprechen die folgenden polycyklischen Aromaten der Hückelregel?
- Wähle zwei beliebige Verbindungen dieser Seite und male jeweils zwei mesomere Grenzstrukturen
Zusatzinformationen: Polyzyklische aromatische Kohlenwasserstoffe
Freiarbeit Aromaten: 3. Die elektrophile aromatische Substitution

- Erkläre mit Deinen Worten den Ablauf und die Reaktionsschritte der katalytischen Sulfonierung von Benzol. Beachte dabei die drei mesomeren Grenzstrukturen in der Klammer. Damit die Reaktion abläuft, verwendet man übrigens frisch konzentrierte Schwefelsäure, welche immer auch etwas Schwefeltrioxid (SO3) enthält. Dieses verbindet sich mit Protonen der Schwefelsäure zu (HSO3)+.
- Suche aus zwei verschiedenen Chemiebüchern (oder aus dem Internet) den Ablauf einer Halogenierung eines Aromaten (z.B. der Bromierung von Benzol). Schau genau hin und suche Gemeinsamkeiten und Unterschiede. Erstelle dann eine eigene Zeichnung für deine Unterlagen.
- Zeichne ein Energiediagramm unter deine Version der aromatischen, Eelektrophilen Substitution und ordne dem Energiediagramm dann die passenden Substanzen zu.
- Wie würde das Energiediagramm aussehen, wenn stattdessen eine Addition von Brom am Aromaten stattfinden würde?
Freiarbeit Aromaten: 4. Phenol und seine Besonderheiten

- Lies in Deinem Buch über Phenol und seine Eigenschaften nach und erstelle dann einen Kurzsteckbrief (Vorkommen, Eigenschaften, Verwendung). Beantworte dann, ob es eher ein Alkohol, eine Lauge, eine Base oder eine Säure ist.
- Wenn Phenol ein Proton abgibt, liegt das einfach negative Phenolation vor. Zeichne es und finde insgesamt 5 mesomere Grenzstrukturen. (Tipp: die Ladung ist nicht immer am Sauerstoff!)
- Wie interpretierst Du die folgende Regel: „Je mehr mesomere Grenzstrukturen vorliegen, desto stabilisierter ist ein Ion und somit ist seine Existenz wahrscheinlicher“
- Erstelle die Protolysegleichung der Reaktion von Phenol mit Wasser sowie die Reaktionsgleichungen der Reaktion mit Natrium und Natronlauge. Kennzeichne dann das Natriumphenolation.
- Wozu wird Phenol verwendet?
- Phenol als Substituent an Kohlenstoffketten oder anderen aromatischen Ringen wird Phenyl genannt. Wie ist eigentlich die Summenformel von Phenyl?
- Zur Erfreuung des Chemikerherzens. Konjugierte π-Elektronensysteme sind ab einer gewissen Länge farbig. Phenolphtalein hat ein solches umfangreiches konjugiertes π-Elektronensystem. a) Warum entfärbt es sich bei Säurezugabe? Für Nomenklaturmasochisten: benenne es korrekt!
Zusatzinformationen:
Freiarbeit Aromaten: 5. Anilin - ist keine Lauge, aber eine Base
- Lies in Deinem Buch über Anilin und seine Eigenschaften nach und erstelle dann einen Kurzsteckbrief (Vorkommen, Eigenschaften, Verwendung). Beantworte dann, ob es eher eine Lauge, eine Säure oder eine Base ist.
- Erstelle die Reaktionsgleichung der Säure-Base-Reaktion von Anilin mit Salpetersäure.
- Wiederhole die Säure und Base Definitionen nach Brönstedt. Kennzeichne dann jeweils das korrespondierende Säure-Base-Paar der Reaktion aus der vorherigen Aufgabe.
- Weltweit werden ca. 1 Mrd. kg Anilin benötigt. Wozu wird es eigentlich verwendet?
- Welches wäre der korrekte IUPAC-Name von Anilin?
- Wie sieht im Vergleich Nitrobenzol aus?
Zusatzinformationen: Anilin
Freiarbeit Aromaten: 6. Toluol und andere Benzol Derivate
- Lies in Deinem Buch über Toluol, Benzoesäure, Xylol und Styrol nach und erstelle dann jeweils Kurzsteckbriefe (Vorkommen, Eigenschaften, Verwendung).
- Di-Methylbenzol (=Xylol) liegt in insgesamt drei Isomeren vor. Zeichne sie. Sie werden als ortho-, meta bzw para-Xylol bezeichnet.
- Formuliere die Reaktionsgleichung für die Kern- bzw. Seitenkettenbromierung von Toluol.[4]
- Zeichne die drei Isomeren Trimethylbenzole.
- Formuliere die Reaktion von Benzoesäure mit Kalilauge.
- Zeichne 2,4,6-Trinitromethylbenzen (=TNT). (Nitro- als Substituent bezeichnet Nitrit (ohne Ladung), also NO2)
- Wie müssen die Zwischenstufen der oxidativen Herstellung von Benzoesäure aus Toluol aussehen? Zeichne und benenne sie:
Zusatzinformationen:
- ↑ konjugiert bedeutet, dass abwechselnd einfache und Doppelbindungen vorliegen
- ↑ 1pm = 1/1000 000 000 000 m = 10-12m
- ↑ Thio = Schwefel
- ↑ Hier gilt die KKK oder SSS Regel
Carbonylverbindungen
Darstellung von Aldehyden und Ketonen aus Alkoholen
a) Die Reaktion von Kupferoxid mit Ethanol
V: Frisch oxidiertes (noch heißes) CuO wird in Ethanol/ Spiritus gegeben
B: Das schwarze Kupferoxid wird wieder rötlich/ kupferfarben, aromatischer Geruch
S: Es hat sich Kupfer gebildet → es fand eine Reduktion von CuO statt. Reduktionen laufen aber immer zusammen mit Oxidationen ab (=Redoxreaktionen). Wer wurde also oxidiert?
→ Ethanol muss oxidiert worden sein.
- Ethanol und Kupfer(II)-Oxid reagiert zu Ethanal und elementarem Kupfer und Wasser
Kupferoxid wird zu Kupfer reduziert, d.h. die Fläche des schwarzen Blechs, das mit Alkohol in Berührung kommt wird wieder blank. Die bei dieser Reduktion aufgenommenen Elektronen werden vom Ethanol abgegeben, welches so zu Ethanal oxidiert.
Bestimmen von Oxidationszahlen in organischen Molekülen
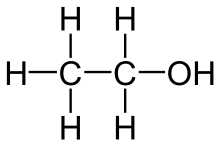
- Zur Bestimmung von Oxidationszahlen werden in organischen Verbindungen zuerst alle Bindungen hinsichtlich der Elektronegativitätsdifferenzen untersucht und dann dem jeweils elektronegativeren Bindungspartner die Bindungselektronen „zugeteilt“.
- Die Anzahl der Bindungselektronen, die nach der vorherigen Zuordnung „noch mit einem Atom in Kontakt“ sind, wird gezählt und mit der Stellung (also der Haupt-gruppennummer) im PSE verglichen. Im Falle des oberen Kohlenstoffs (siehe Bei-spiel) sind ihm 5 Elektronen zugeordnet, d.h, im Vergleich zur Stellung im PSE (4. HG) hat er ein (negatives) Elektron zuviel → die Oxidationszahl ist -I.
- Aufgaben
- Bestimme nach dieser Methode alle Oxidationszahlen in CO2, C6H12O6, Isobutanol, einer Aminosäure Deiner Wahl.
- Zusatzinformationen
Die Reaktion von Butanol mit Kaliumdichromat (theoretischer Versuch)
Material: 3 Reagenzgläser oder Erlenmeyerkolben, 1-Butanol, 2-Butanol, 2-Methyl-2-Propanol (tertiärer Alkohol), schwefelsaure Kaliumdichromatlösung Tipp: Alkohole auf ca. 40°C im Wasserbad vorwärmen.
Vom Butanol gibt es drei verschiedene Isomere. Man bezeichnet sie als primäres, sekundäres und tertiäres Butanol. Reagieren sie bei Redoxreaktionen unterschiedlich?
Darstellung von Aldehyden aus primären Alkoholen
V1: In einem Erlenmeyerkolben werden 10ml 1-Butanol (=primäres Butanol) mit 3ml schwefelsaurer Kaliumdichromatlösung versetzt. Dann wird das Gemisch leicht erwärmt.
B1: Farbumschlag von orange nach grün
Darstellung von Ketonen aus sekundären Alkoholen
V2: In einem Erlenmeyerkolben werden 10ml Butan-2-ol (=sekundäres Butanol) mit 3ml schwefelsaurer Kaliumdichromatlösung versetzt. Dann wird das Gemisch leicht erwärmt.
B2: Farbumschlag von orange nach grün, anderer Geruch als bei V1
Darstellung mit tertiären Alkoholen
V3: In einem Erlenmeyerkolben werden 10 ml 2-Iso-Butanol (=tertiäres Butanol) mit 3 ml schwefelsaurer Kaliumdichromatlösung versetzt. Dann wird das Gemisch leicht erwärmt.
B3: kein Farbumschlag → keine Reaktion!
Schlussfolgerungen V1-V3:
Primäre und sekundäre Alkohole reagieren mit Kaliumdichromat (K2Cr2O7). Es bildet sich dabei das grüne Cr-(III). Unter diesen Reaktionsbedingungen findet keine Reaktion bei tertiären Alkoholen statt.
S1: Die orange Reagenzlösung färbt sich auf Grund der entstehenden Cr3+‑Ionen grün
Der primäre Alkohol wird zum Aldehyd oxidiert.
- Ein Alkohol reagiert mit Kaliumdichromat und Oxoniumionen zu einem Aldehyd, Chrom-(III)-Ionen und Wasser.
S2: Die Reagenzlösung färbt sich auf Grund der entstehenden Cr3+‑Ionen grün
Der sekundäre Alkohol wird zum Keton oxidiert.
- Reduktion
- Oxidation
Aldehyde und Ketone können durch „Dehydrierung“ von Alkoholen erhalten werden (so kamen sie früher zu ihrem Namen: Alcoholus dehydrogenatus = Aldehyd).
Tertiäre Alkohole lassen sich nicht auf diesem Wege oxidieren.
- Zusatzinformationen'
Auch tertiäre Alkohole können oxidiert werden - aber nur mit etwas mehr Gewalt. Dabei müssen dann C–C-Bindungen gespalten werden. Es entstehen Kohlenstoffdioxid und Wasser.
Wiederholung: Schritte zum Erstellen der Redoxreationsgleichungen
Die folgenden Schritte sollen für Dich ein Rezept darstellen, nach dem Du vorgehen kannst, wenn Du in Zukunft Reaktionsgleichungen für Redoxreaktionen aufstellst. Bei einfachen Aufgaben kannst Du den Schritt 5 & 6 überspringen.
Eine kleine Warnung für alle Schnellrechner: Überspringst Du einen Schritt, wird das Ergebnis in der Regel falsch sein!
- Unvollständige Gleichung aus dem Experiment aufstellen (Ausgangsstoffe → Produkten)
- Oxidationszahlen ermitteln (Oxidation und Reduktion bestimmen)
- Teilgleichungen aufstellen
- Anzahl der jeweils aufgenommenen oder abgegebenen e- ermitteln
- Ladungsausgleich - in alkalischer Lösung mit (OH)- (=Hydroxidionen) - in saurer Lösung durch (H3O)+ (=Oxoniumionen)- (in manchen Büchern wird auch mit O2- ausgeglichen)
- Stoffbilanz mit Wasser
- Elektronenanzahl der Teilgleichungen untereinander durch Multiplikation ausgleichen
- Teilgleichungen „addieren“ und so die gesamt Gleichung aufstellen. Fast fertig!
- Überlegen, ob Energie benötigt oder freigesetzt wird
- Überprüfung der Gleichung durch Probe (Dazu zählt man wie oft jedes Element und jede Ladung auf beiden Seiten vorkommt - die Zahlen müssen immer gleich sein!)
Tipps:
- Nur Wasserstoff, Stickstoff, Sauerstoff und die Elemente der 7. HG kommen als zweiatomiges Element vor: → H2, N2, O2, F2, Cl2, Br2, I2 (es gibt also niemals Fe2 oder Al4 als Element!)
- Überlege Dir immer gut, ob die Formel, die Du gerade erstellt hast, überhaupt logisch ist und sie Dir bekannt vorkommt. Ein einfaches Zusammenzählen aller Atome ist nämlich nur sehr selten die richtige Lösung: z.B. verbrennt CH4 + O2 nicht zu CH4O2, sondern zu CO2 + H2O (Kohlenstoffdioxid und Wasser).
- Zusatzinformationen
Schrittweise Lösung der Redoxreaktion am Beispiel: Ethanol wird zu Ethanal oxidiert
- Ausgangsstoffe und Endstoffe aufstellen: (CrVI2O7)2-, Ethanol → Ethanal, Cr3+
- Oxidationszahlen bestimmen
- Teilgleichungen aufstellen, Oxidations- und Reduktionsschritt bestimmen
red: (CrVI2O7)2- → 2 CrIII 3+ O
ox: H3C–H2C-I-O-H → H3C–CI H - Elektronenanzahl der jeweils aufgenommenen oder abgegebenen e- ermitteln
red: (CrVI2O7)2- + 3e- → 2 CrIII 3+ O
ox: H3C–H2C-I–O-H → H3C–CI + 2e- H - Ladungssumme ausgleichen (beachten: saures Milieu (H3O+/H2O) oder alkalisch (OH-/H2O)?)
red: (CrVI2O7)2- + 6e- + 14H3O+→ 2 CrIII 3+ O
ox: H3C–H2C-I–O-H + 2H2O → H3C–CI + 2e- + 2H3O+ H - Stoffbilanz mit Wasser red: (CrVI2O7)2- + 6e- + 14H3O+ → 2 CrIII 3+ + 21H2O
ox: H3C–H2C-I–O-H + 2H2O → H3C–CI + 2e- + 2H3O+ H - Elektronenzahlen der Teilgleichungen untereinander ausgleichen
red: (CrVI2O7)2- + 6e- + 14H3O+ → 2 CrIII 3+ + 21H2O
ox: 3 H3C–H2C-I–O-H + 2H2O → 3H3C–CI + 6e- + 6H3O+ |·3 \ H - Teilgleichungen addieren (e-, H2O, H3O+ „kürzen“) O
(Cr2O7)2- + 8H3O+ + 3H3C–H2C–OH + → 2Cr3+ + 15H2O + 3H3C–C H - Überlegen, ob Energie benötigt oder freigesetzt wird: Die Reaktion ist minimal exotherm
- Probe Cr: 2/2, H: 24 + 18/ 30 + 12 (Summe: 42), O: 7+8+3/ 15+3 (Summe: 18)
Was sind Aldehyde?
Aldehyde ( auch Alkanale genannt) sind Verbindungen, welche als funktionelle Gruppe mindestens eine endständige Carbonylgruppe besitzen. Diese wird dann auch als Aldehydgruppe bezeichnet. Natürlich existieren auch Mehrfachaldehyde - diese tragen Aldehydgruppen z.B. an zwei offenen Enden der Kohlenstoffkette.
Der Name „Aldehyd“ leitet sich als Kurzform von lateinisch alcohol(us) und dehydrogenatus ab (dehydrierter Alkohol).
Die Aldehydgruppe am Beispiel des einfachsten Aldehyds:

Durch ihre funktionelle Gruppe sind Aldehyde recht reaktiv.
- Doppelbindungen sind reaktiver als Einfachbindungen. Bei Aldehyden ist die polare Doppelbindung (durch das elektronegative Sauerstoffatom) besonders reaktiv für Additionsreaktionen. Die Polarisierung der Doppelbindung aktiviert also die Doppelbindung noch stärker. Sie ist somit ein guter Ansatzpunkt für nukleophile Additionen
- Die Polarisierung der Doppelbindung wirkt sich ebenfalls auf die C-H Bindung aus (-I-Effekt). Die Folge ist eine Zunahme der Azidität. (Ein Elektronenmangel am Kohlenstoff wird teilweise durch eine Verlagerung der C-H Bindung kompensiert. Dadurch wird die C-H Bindung stärker polarisiert und somit geschwächt: → Ein Proton (H+) kann leichter abgegeben werden.→ Aldehyde reagieren leicht sauer!
- Bei Aldehyden gibt es oft eine Keto- und Enolform (Keto-Enol-Isomerie)[1].
Nomenklatur
Aldehyde werden durch den Namen des Alkans und der Endung -al bezeichnet[2] (Methan → Methanal, Ethan → Ethanal usw.).
Da viele Aldehyde den Menschen bereits lange bekannt sind, haben sie zusätzlich oft noch ihre historisch entstandenen Trivialnamen. Man sollte die ersten drei zumindest mal gehört haben, da sie scheinbar unausrottbar sind ;-)
Diese Trivialnamen leiten sich von der weiteroxidierten Form des Aldehyds (der Carbonsäure) ab. Für Methanal ist die oxidierte Form Methansäure (lat. acidum formicum) → Formaldehyd
Für Ethanal ist die oxidierte Form Ethansäure (lat. acidum aceticum → Acetaldehyd usw.
| IUPAC-Bezeichnung | Trivialnamen | Siedepunkt in °C | Summenformel[3] |
|---|---|---|---|
| Methanal | Formaldehyd | -19,5 | CH2O |
| Ethanal | Acetaldehyd | 21 | CH3CHO |
| Propanal | Propionaldehyd / Propylaldehyd | 48 | C2H5CHO |
| Butanal | Butyraldehyd | 75 | C3H7CHO |
| Pentanal | Valeraldehyd / Amylaldehyd | 103 | C4H9CHO |
| Hexanal | Capronaldehyd / Hexaldehyd | 131 | C5H11CHO |
| Heptanal | Oeanantaldehyd / Heptaldehyd | 153 | C6H13CHO |
| Octanal | Caprylaldehyd / Octylaldehyd | 171 | C7H15CHO |
| Nonanal | Pelargonaldehyd / Nonylaldehyd | 193 | C8H17CHO |
Verwendung und Vorkommen von Aldehyden
- Vor allem Formaldehyd (=Methanal) wird als Ausgangsstoff in der chemischen Industrie häufig verwendet (Ausgangsstoff u.a. für die Herstellung von Kunststoffen, Lösungsmitteln, Farbstoffen, Parfums und Medikamenten).
- Da es giftig ist und außerdem im Verdacht steht krebserzeugend zu sein, wird es als reines Produkt nicht mehr verwendet. Man findet es teilweise auch heute noch in Desinfektionsmitteln (die so genannte Formalinlösung) und als Flüssigkeit in organischen, biologischen Präparaten.
- Die Giftigkeit des Formaldehyds kommt u.a. dadurch zustande, dass es ein starkes Reduktionsmittel ist.
- Teilweise findet man Formaldehyd auch in neu erworbenen Kleidungsstücken! Es soll einem Befall mit Schädlingen in Lagerhäusern der wärmeren Zonen vorbeugen. Aus diesem Grunde ist es immer empfehlenswert neue Kleidung vor dem Tragen gut zu waschen (v.a. billige Kleidungsstücke!).
- Aldehyde spielen im menschlichen Stoffwechsel eine wichtige Rolle als Zwischenprodukt. Ethanal entsteht z.B. im Verlauf der Abbaureaktion in der Leber. Es ist maßgeblich für den „Kater“ verantwortlich.
Letztlich muss noch erwähnt werden, dass einige Zucker Aldehyde oder Ketone sind:

Reaktionen der Aldehyde
a) Nukleophile Additionen an Aldehyden
- Ein nukleophiles Teilchen mit seinen freien Elektronenpaaren (z.B. ein Molekül wie H2O) wird durch die C=O Doppelbindung angezogen und bindet an den Kern des Kohlenstoffatoms (da dieser elektropositiver ist). Der Sauerstoff bekommt durch das Anbinden eine negative Ladung. Liegen freie Protonen vor (also bei Reaktionen in Wasser oder im sauren Milieu) findet dann eine Verbindung zwischen dem negativen Sauerstoff und einem Proton statt (OH-Bildung aus der Carbonylgruppe).
- Oxidation von Aldehyden zur entsprechenden Carbonsäure (wichtige Nachweisreaktion).
b) Addition von Wasser an Aldehyde und Ketone - Hydratbildung
Mischt man Aldehyde (z.B. Ethanal) mit Wasser, bilden sich so genannte Aldehydhydrate. Diese Reaktion gelingt besser, wenn sie im leicht Sauren stattfindet:

Nach der Protonierung der Carbonylgruppe greift das Wassermolekül als Nucleophil mit dem freien Elektronenpaar seines Sauerstoffatoms den elektrophilen Carbonylkohlenstoff an. Ein Proton wird abschließend wieder abgespalten.
c) Addition von Alkohol an Aldehyde und Ketone - Halbacetalbildung
Die Reaktion funktioniert im Grunde wie die Vorherige, nur dass statt Wasser ein Alkohol verwendet wird.
d) Addition von Halbacetalen an Aldehyde und Ketone - Acetalbildung
- Halbacetal + Alkohol → Acetal + Wasser
Beispiel: Ringschluss bei Zuckermolekülen (Zucker sind Aldehyde!)
e) Aldolreaktion
Gibt man zu Aldehyden eine Base, so reagiert diese durch Abspaltung in der Regel mit dem aziden Wasserstoff zu Wasser.


Das gebildete Aldol ist also ein Kondensationsprodukt aus Alkohol und Aldehyd. Dies ist eine Möglichkeit neue C–C Bindungen zu bilden, bzw. Moleküle zu verknüpfen.
- Nachweise von Aldehyden
- Tollensprobe
- Fehlingprobe
- Schiffsche Probe
- Zusatzinformationen
Oxidation von Glycerin
Es gibt zwei Möglichkeiten:
- Aldehydbildung
- Glycerin reagiert mit Kupfer(II)-oxid zu 2,3-Di-Hydroxy-1-Propanal und Kupfer
- Ketonbildung
- Glycerin reagiert mit Kupfer(II)-oxid zu 1,3-Di-Hydroxy-2-Propanon und Kupfer
Die sich dahinter verbergende Reaktion ist eine Redoxreaktion.
Was sind Ketone?

In Ketonen liegt ebenfalls eine Carbonylgruppe vor. Der Sauerstoff ist wieder mit einer Doppelbindung an einen Kohlenstoff gebunden. Der Kohlenstoff ist allerdings sekundär, d.h. er hat zwei Kohlenstoffnachbarn.
Ketone entstehen durch Oxidation sekundärer Alkohole. Sie werden auch Alkanone genannt. Das einfachste Keton ist Propanon (=Aceton).
Die Verwendung der Ketone entspricht ungefähr der Verwendung der Aldehyde (für chemische Industrie, Medizin-, Kosmetik- und Parfüm-Industrie).
- Nomenklatur
Ketone haben den Alkanen entsprechende Namen mit der Endung -on.
(Propan → Propanon usw.)
- Eigenschaften
- Ketone geringer Kettenlänge sind leicht polar und somit in Wasser löslich.
- kurzkettige Ketone sind dünnflüssige, farblose Flüssigkeiten.
- eine weitergehende Oxidation von Ketonen zur Carbonsäure ist nicht möglich. Dies ist der chemische Unterscheidungshinweis zu den Aldehyden (welche die Carbonsäuren bilden können).
- Wenn Ketone oxidieren, dann nur unter Aufbrechen einzelner C–C Bindungen zu Kohlenstoffdioxid und Wasser.
- Das C, welches mit der Ketongruppe verbunden ist, wird durch seine Nachbarn mit einem +I-Effekt stabilisiert.
- Ketone zeigen eine niedrigere Reaktionsfreudigkeit im Vergleich zu den Aldehyden.
- Ketone riechen in der Regel angenehmen und fruchtig.
- Herstellung
- Neben der Oxidation von sekundären Alkoholen ist die wichtigste Herstellungsmethode für aromatische Ketone die Friedel-Crafts-Acylierung. (LK)
- Reaktionen
- Auch Ketone (so wie Aldehyde) zeigen Additions- und Kondensationsreaktionen.
- Gleichgewichtsreaktion der Ketone mit ihrer tautomeren Form, den Enolen (Keto-Enol-Tautomerie) (LK)
- Wichtige Vertreter der Ketone
Aceton, Cyclohexanon, Absinthol, Himbeerketon, Mycosporin
- Zusatzinformationen
Reaktionen von Aldehyden und Ketonen mit Kaliumpermanganat
Material: Ethanol, Propanon, schwefelsaure Kaliumpermanganatlösung.
V: Im Reagenzglas gibt man zu wenig Ethanal bzw. Propanon schwefelsaure Kaliumpermanganatlösung, leicht erwärmen.
B: Essiggeruch, es entsteht zuerst ein brauner Niederschlag, dann eine farblose Lösung.
S: Der Ansatz mit Ethanal entfärbt sich unter Bildung von Essigsäure und anfänglichem braunen MnO2 Niederschlag. Dann bilden sich farblose Mn2+-Ionen.
Aldehyde lassen sich im Gegensatz zu Ketonen mit schwefelsaurer Kaliumpermanganatlösung zu Carbonsäuren oxidieren.
- Aufgaben
- Propanon geht unter diesen Bedingungen keine Redoxreaktion ein. Warum eigentlich nicht?
Nachweisreaktionen für Aldehyde
a) Silberspiegelprobe (Tollensreaktion)
V: Herstellen der Nachweisreagenz (Tollensreagenz): In ein fettfreies RG werden einige Tropfen AgNO3-Lösung und soviel verdünnte Ammoniaklösung getropft, bis sich der anfangs gebildete weiße Niederschlag wieder auflöst. Evtl. kann noch etwas OH- zugefügt werden.
Zu dieser klaren Lösung werden 2ml eines Aldehyds (z.B. Ethanal, für einen schönen Silberspiegel kann man auch eine Spatelspitze Glucose in 1ml Wasser nehmen) zugegeben.
Beide Lösungen werden vermischt und in ein Becherglas mit fast kochendem Wasser gestellt (T>70°C). Das RG nicht bewegen!
B: An der Glaswand bildet sich nach ca. 5min. ein Silberspiegel.
S: Die Silberanionen werden durch das Aldhyd (bzw. der „Aldehydform“ der offenen Form der Glucose) zu elementarem Silber reduziert. Das Aldehyd reagiert zur Carbonsäure (aus Glucose entsteht Gluconat.[4]).
Die Funktionsweise[5] der Tollensreaktion am Beispiel des Ethanals (Redoxreaktion)
- Zusatzinformationen
b) Die Fehlingprobe
V: In je einem RG wird 1ml Propanal bzw. Aceton gefüllt. Man gibt 2ml Fehling I und 2ml Fehling II - Lösung hinzu. (1:1) hinzu und erhitzt unter dauerndem Schütteln bis zum Sieden.
Hinweis: Fehling 1: verdünnte CuSO4 Lösung
(z.B. 7g Kupfersulfatpentahydrat auf 100 ml Wasser)
Fehling 2: alkalische Kaliumnatriumtartrat-Lösung (10g NaOH in 50 ml Wasser auflösen und darin 34g Kaliumnatrium-tartrat-tetrahydrat (KNaC4H4O6 · 4 H2O) auflösen und dann auf 100ml auffüllen).
Vorsicht beim Erhitzen. Siedeverzug und Entzündungsgefahr!
B: Propanol und Fehlingreagenz färbt sich nach dem Erhitzen von tiefblaue (klare Lösung) zu ziegelrot (trübe Lösung).
Aceton und Fehlingreagenz regaieren nicht!
S: Cu2+ Ionen sind blau gefärbt. Cu+ Ionen liegen im Tartratkomplex[6] in einer roten Farbe vor. (freie Cu+ Ionen sind eher grün!). → es findet also eine Redoxreaktion statt:
Die Aldehydgruppe reduziert das Cu(II)-Ion der Fehlingschen Lösung zu rotem Cu(I)-oxid[7]. Mit Ketonen ist diese Reaktion nicht möglich, da diese nicht weiter oxidiert werden können.
Oxidation:
- Eine Aldehydgruppe wird im basischen zur Carbonsäure oxidiert.
Reduktion:
- Kupfer(II)-ionen und Hydroxidionen reagieren zu Kupfer(I)-hydroxid, das weiter zu Kupfer(I)-oxid dehydratisiert.
Redoxreaktion:
- Kupfer(II)-ionen und Aldehydgruppen reagieren im basischen Milieu zu Kupfer(I)-oxid, Carboxylaten und Wasser
Da man sich im alkalischen Milieu befindet, kommt es zu einer Abgabe des Protons der Carbonsäure (=Protolyse).
- Da die Reaktion in alkalischer Umgebung stattfindet, wird die entstehende Carboxygruppe durch Hydroxidionen zur Carboxylatgruppe im Sinne einer Säure-Base-Reaktion deprotoniert
Die Fehlingreaktion funktioniert auch mit Alkoholen, da auch diese oxidiert werden können und so Elektronen für eine Kupferionenreduktion bereitstellen können.
- Zusatzinformation
c) Schiffsche Probe und Unterscheidung von Methanal, Ethanal und Propanon (LK)
siehe Schiffsche Probe
Aceton
Propanon ist das einfachste Keton. Es liegt bei Raumtemperatur als farblose, aromatisch riechende und leicht flüchtige Flüssigkeit vor. Es hat eine sehr geringe Viskosität - es ist also sehr dünnflüssig.
Sein Trivialname ist Aceton. Viele organische Stoffe, welche häufig verwendet werden haben Trivialnamen - welche vor allem im Laboralltag und in der Bevölkerung recht üblich sind.
- Verwendung
- als Lösungsmittel für fettlösliche Stoffe
- als Reingungsmittel (z.B. früher in Nagellackentferner)
- als Ausgangsstoff für andere chemische Synthesen
- Lösungs- und Extraktionsmittel für Harze, Fette und Öle
- Aceton löst ein Vielfaches seines eigenen Volumens an Acetylen
- Ausgangsstoff u.a. für die Aldoladditionen und Aldolkondensationen
- zusammen mit Wasserstoffperoxid ist Aceton eines der Ausgangsstoffe für die Herstellung des Sprengstoffes Acetonperoxid.
- In den USA und anderen Ländern wird Aceton in geringer Menge (1:2000 - 1:5000) Autokraftstoffen (Benzin und Diesel) zugefügt.
- Weitere Eigenschaften
- Die Dämpfe sind leicht entzündlich und bildet mit Luft ein explosives Gemisch. Die hohe Flüchtigkeit ist auf den niedrigen Siedepunkt zurückzuführen (56°C).
- Aceton kann in jedem Verhältnis mit Wasser gemischt werden. Weiterhin ist es mit den meisten organischen Lösungsmitteln ebenfalls mischbar.
- Das Acetonmolekül zeigt Keto-Enol-Tautomerie
- sein pKs-Wert beträgt 20.
- In alkalischer Umgebung bildet zwei Acetonmoleküle Dimere (Diacetonalkohol).
- Zusatzinformationen
Wiederholungsfragen
- Nukleophile Substitution
- Nenne gute Nukleophile.
- Stelle SN1 und SN2 an selbst gewählten Beispielen gegenüber. nenne dann jeweils eine Beispielreaktion. Formuliere in Worten die Unterschiede.
- Vervollständige für SN2: Die Bindung zur ________________ wird in dem Maße gelöst wie sich die Bindung zum ___________________ bildet.
- Wann spricht man bei der nukleophilen Substitution von einer bimolekularen Reaktion?
- Erstelle den Mechanismus: (CH3)3COH + H-Cl → (CH3)3C-Cl + H-OH
- Erstelle zu SN1 und SN2 jeweils ein vollständiges Energiediagramm.
- Carbonylverbindungen
- Was sind Carbonylverbindungen? Welche Gruppen kennst Du? Nenne Eigenschaften.
- Nenne Verwendungszwecke für Ketone und Aldehyde.
- Welches sind typische Reaktionen von Aldehyden/ Ketonen?
- Wiederhole die Regeln der Nomenklatur. Welche Besonderheiten gibt es bei Alkoholen, Aldehyden und Ketonen zu beachten?
- Kennst Du Trivialnamen? Schreibe die Konstitutionsformeln von Formaldehyd, Acetaldehyd und Aceton auf.
- Benenne die folgenden Verbindungen:
- Welche drei prinzipiellen reaktiven Positionen gibt es prinzipiell in Aldehyden und Ketonen?
- Vervollständige die Tabelle.
- Stelle die vollständige Oxidation eines beliebigen primären Alkohols mit der eines sekundären (in allen Schritten, also mit allen Produkten, wie z.B. Aldehyd, Keton, Carbonsäure, CO2) gegenüber
- Wiederhole die Dir aus dem Unterricht bekannten Redoxreaktionen.
- Beschreibe die Reaktion von Kupferoxid mit Ethanol.
- Wie oxidieren tertiäre Alkohole? Nenne alle Produkte!
- Nenne Möglichkeiten primäre Alkohole von sekundären im Labor zu unterschieden. Begründe. mit den passenden Reaktionsgleichungen.
- Alkoholstoffwechsel der Leber:
| Name | funktionelle Gruppe | Endung | Bezeichnung als zus. Substituent |
|---|---|---|---|
| -COOH | |||
| Aldehyd | |||
| -on | |||
| Hydroxy | |||
| Amin | Amino |
- Wiederhole die Regeln zur Bestimmung von Oxidationszahlen, vor allem an organischen Verbindungen. Erstelle dann eine Tabelle mit den Oxidationszahlen der folgenden Verbindungen.
| Methan | Propan | Butan | Propen |
| Methanol | Propanol | Butanol | tert.-Butanol |
| Methanal | Propanal | Butanal | Aceton |
| Propanon | Butanon | Dimethylketon | |
| Methansäure | Propansäure | Butansäure | Essigsäure |
Im menschlichen Körper wird in der Leber Ethanol durch das Enzym Alkoholdehydrogenase im Zusammenspiel mit dem Coenzym Nicotinamidadenindinucleotid (NAD) oxidiert.
a) Bestimme das fehlende Produkt. Tipp: Es ist leicht giftig und verursacht Kopfschmerzen.
- CH3–CH2–OH + NAD -ADH→ ? + NADH
b) Das Produkt aus a) wird in einem weiteren Schritt weiter oxidiert und dann letztlich ausgeatmet. Erstelle auch diese Reaktionsgleichung.
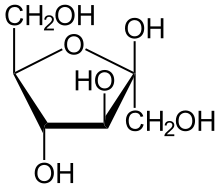
- Zucker können sowohl in der kettenförmigen Form, als auch in Ringform auftreten. Wie wirkt sich dies auf Nachweise aus? Glucose zeigt eine positive Fehlingprobe. Was erwartest Du für Fructose? Erkläre anhand der Formel.
- Was sind Ether? Nenne Eigenschaften und Verwendung.
- Wiederhole die anderen Reaktionsmechanismen.
- Erkläre, wie sich Siedepunkte von Alkanen, Alkanolen und Alkanalen gleicher Kohlenstoffkettenlänge verhalten?
- Vergleiche entsprechend die Löslichkeit von Alkanen, Alkanolen und Alkanalen in Wasser. Erkläre dabei auch, welche Vorgänge beim Lösungsvorgang eine Rolle spielen - und inwiefern die Verbindungen diese Vorgänge ermöglichen.
- ↑ Siehe auch Keto-Enol-Tautomerie
- ↑ also im Grunde entsprechend den Alkoholen
- ↑ Die allgemeine Summenformel ist CnH2n+1CHO
- ↑ Zusatzinformationen Silberspiegelprobe: Beim Zutropfen des Ammoniaks ist der entstehende braune Niederschlag Silberhydroxid (AgOH). Er verschwindet unter Bildung des Silberdiamminkomplexes ([Ag(NH3)2]+).
- ↑ Hier ist die vereinfachte Form dargestellt. In Wirklichkeit liegt als Edukt der Silnberaminkomplex vor [Ag(NH3)2]+
- ↑ Tartrate sind die Salze der Weinsäure. Siehe auch Kapitel Carbonsäuren.
- ↑ Bemerkung: Die Gelbfärbung zu Beginn der Reaktion kommt vom bereits gebildeten Cu(I)-Oxid
Kohlenhydrate
Was sind Zucker (Saccharide)?
Einführungsversuch zum Beweis der chemischen Zusammensetzung von Zuckern
V: a) In ein Reagenzglas werden ca. 1-2 cm Haushaltszucker ( Saccharose) gefüllt, dieser leicht befeuchtet und dann konzentrierte Schwefelsäure zugefügt.
b) H2SO4 + CuSO4 werden Haushaltszucker zugefügt.
B: a) schwarze kohleartige Masse und ein unangenehmer Geruch.
S: Konzentrierte H2SO4 hat eine Wasser entziehende (=hygroskopische) Wirkung → Name „Kohlenhydrate“: „Hydrate des Kohlenstoffs“ (allerdings alte Vorstellung!)
Geruch: Es bildet sich zusätzlich in geringen Mengen ein Umlagerungsprodukt: Maltol - welches auch in Ananasaroma zu finden ist.
Kohlenhydrate haben die allg. Formel: Cm(H2O)n [oft vereinfacht: Cn(H 2O)n]
die bekanntesten Kohlenhydrate sind die Zucker.
Bedeutung der Kohlenhydrate
- zentrale Rolle für das ganze biologische Leben.
- werden von allen Lebewesen als Energieträger verwendet.
- einfache Kohlenhydrate werden in Tieren und im Menschen zur Speicherung in Glycogen umgewandelt.
- einfache Kohlenhydrate werden in Pflanzen zur Speicherung in Stärke und zum Pflanzenaufbau in Zellulose umgewandelt.
- durch Oxidation von Kohlenhydraten wird deren innere Energie freigesetzt. Sie dient zum Erhalt der Lebensvorgänge.
- der natürliche Aufbau geschieht in Pflanzen. Ausgang dafür ist die Photosynthese.
- Verwendung als pflanzlicher Baustoff: Cellulose
Einteilung der Kohlenhydrate
Nach Anzahl der „Bausteine“:
- Einfachzucker (Monosaccharide) Saccarum (lat.) = Zucker
- Mehrfachzucker (Oligosaccharide)
- Vielfachzucker (Polysaccharide)
Nomenklatur der Kohlenhydrate
Endung: -ose
(Diese Endung taucht auch bei den häufig verwendeten Trivialnamen der Zucker auf: Cellulose, Glucose, Maltose, Saccharose etc.)
Die süße Wirkung von Kohlenhydraten
Zucker ist süß → auch Glycerin, Glykol (Weinskandal) sind süß.
→ Die OH-Gruppen in Zuckern sind für den süßen Geschmack verantwortlich.
Demzufolge ist 1,2,3,4,5,6-Hexahydroxy-Hexan eine Verbindung mit süßem Geschmack. Sie wird auch Sorbit genannt und dient als Zuckerersatzstoff.

Funktion der Kohlenhydrate im Körper
- Als Energieträger: Muskelzellen, Gehirnzellen sowie rote Blutkörperchen benötigen Zucker zur Funktion (auch Blutzucker genannt) (1g Glucose entspricht dabei ca. 17 kJ)
- Aufbausubstanz: Aus Glucose und anderen Kohlenhydraten werden komplexere Kohlenhydrate gebildet. Diese sind Bestandteile von Blut, Knochen, Sehnen, Haut, Bindegewebe und DNA.
- Energiespeicher: überschüssiger Blutzucker wird z.B. durch Insulin als Glykogen in Leber und Muskeln gespeichert.
- Polysaccharide (z.B.: Stärke, Cellulose usw.)
- Lignin und Chitin sind ebenfalls Polysaccharide, sie enthalten aber zusätzlich das Element Stickstoff.
Triosen

Zum tieferen Verständnis, was Zucker überhaupt sind, betrachten wir Glycerin als Ausgangssubstanz. Es hat drei Hydroxidgruppen, welche oxidiert werden können. Ob dabei die Oxidation am C1 oder C3 stattfindet, ist unerheblich, da dabei die gleiche Verbindung entsteht.
- Oxidation zum Aldehyd: → Aldose
- Oxidation zum Keton: → Ketose
-
2,3 Di-Hydroxy-Propanal (Trivialname: Glycerinaldehyd)
-
1,3 Dihydroxy-Propanon (Trivialname: Dihydroxyaceton)
Zucker sind Oxydationsprodukte von Polyalkoholen. Da es bei Alkoholen immer die Möglichkeit gibt, sie zu Aldehyden oder Ketonen zu oxidieren, sind Zucker also folglich Polyhydroxyaldehyde oder Polyhydroxyketone.
Anwendung des Gelernten - Welche Verbindungen sind Kohlenhydrate?
Welche der Verbindungen sind Kohlenhydrate? Welche werden eine süße Wirkung haben und welche kannst Du benennen?
-
1.
-
2.
-
3.
-
4.
-
5.
-
6.
-
7.
-
8.
1. D-Glucose, 2. D-Gluconsäure, 3. Sorbit (Zuckerersatzstoff), 4. D-Desoxyribose, 5. D-Weinsäure, 6. D-Fructose, 7. Alanin (Aminosäure), 8. D-Galactose
Typen von Kohlenhydraten
- Monosaccharide (=Einfachzucker)
- Glucose (=Traubenzucker, C6H12O6 - eine Hexose). Vorkommen in Honig, Obst, Süßigkeiten.
- Fructose (=Fruchtzucker, C6H12O6 - eine Hexose). Vorkommen in Obst.
- Galactose (=Schleimzucker, C6H12O6 - eine Hexose). Wichtig für das Immunsystem. Bestandteil von Muttermilch).
- Mannose (C6H12O6 - eine Hexose).
- Verschiedene Triosen (C3).
- Weitere Monosaccharide
- Ribose: C5H10O5
- Desoxyribose: C5H10O4
- Ribulose: C5H10O5
- Glycerinaldehyd: C3H6O3
- Disaccharide (=Zweifachzucker)[1]
- Saccharose (=Rohzucker): Vorkommen in Rüben und Zuckerrohr, Süßigkeiten, (Haushaltszucker)
- Lactose (=Milchzucker): Vorkommen in Milch und Milchprodukten, Süßigkeiten, Medikamenten, uvm.)
- Maltose (=Malzzucker): Vorkommen in Bier, Brot
- Polysaccharide (=Vielfachzucker)
- Amylose (=Stärke) Vorkommen in fast jeder Pflanze, Getreide (Mehl), Kartoffeln, Gemüse
- Glykogen: Zwischenenergiespeicher beim Menschen
- Cellulose: Aufbaustoff für Pflanzen. Vor allem im Holz enthalten (Papierherstellung)
- Pektin: Aufbaustoff für Pflanzen. Vorkommen in Getreide (nur Vollkornmehl!), Gemüse, Hülsenfrüchten und Obst
Verdauung von Kohlenhydraten
Fast alle Kohlenhydrate können vom Menschen verdaut werden. Einige Polysaccharide allerdings nicht. Damit sie durch die Mundschleimhaut, die Magenwand sowie die Darmwand in das Blut gelangen, müssen sie immer erst in Einfachzucker umgewandelt werden. Dazu gibt es Spaltungsenzyme in den jeweiligen Organen.
Bei Polysacchariden dauert dieser Vorgang etwas länger, da sie in mehreren Schritten zu Monosacchariden abgebaut werden. Ihre Sättigungswirkung dauert länger an.
Cellulose und Pektin sind nicht vom Menschen verdaubar. Die notwendigen Enzyme fehlen. Sie gelangen unverdaut in den Enddarm und werden dort von Bakterien verdaut. Dies ist gut für das menschliche Immunsystem (eine Art Trainingslager). Sie werden deshalb auch als Ballaststoffe bezeichnet.
Aufgaben
- Woran kann man erkennen, dass die Reaktion von H2SO4 mit Zucker nicht allein auf die Wasser entziehende Wirkung der Schwefelsäure zurückzuführen ist?
- Worauf ist die besonders schnelle Aufnahme von Traubenzucker in das Blut zurückzuführen?
Zusatzinformationen: Zucker Pektin
Traubenzucker - Glucose - C6H12O6 - eine Hexose

Vorkommen in Früchten, Honig, Blut d. Wirbeltiere (beim Mensch: Blutzuckerspiegel 100 mg/l)
- Glucose (=Traubenzucker) ist Dextrose
Eigenschaften
- weißer, leicht wasserlöslicher, süß schmeckender Feststoff
- vollständige Reduktion: n-Hexan → unverzweigte Kette aus 6 C-Atomen
- positive Fehlingprobe → Aldehydgruppe → Aldohexose
- Ermittlung von Summen und Strukturformel:
- Elementaranalyse:CxH2xOx
- Molekülmasse: 180u
- → Summenformel: C6H12O6
| Löslichkeit in Wasser | Löslichkeit in Methanol | Löslichkeit in Chloroform (HCCl3) | Löslichkeit in Hexan oder Benzin |
|---|---|---|---|
| gut | gering | keine | keine |
Verwendung
- zum Süßen
- zur Konservierung (Marmelade)
- als Zuckercouleur z.B. in Cola (E150) (ist im Grunde verbrannter Zucker!)
Entstehung
- in grünen Pflanzen durch Photosynthese
Bedeutung
- Energieträger und -speicher: Stärke, Glycogen
- dient zum Aufbau der Saccharose
- Baustoff: Cellulose
Nomenklatur
Es wird nur der Trivialname Glucose verwendet. Die genauere Bezeichnung 2,3,4,5,6 Pentahydroxy-1-Aldehyd.
Reaktionen von Glucose
- a) Nachweise
positive Fehlingprobe: 2Cu2+ + 4(OH)– + R-CH=O → Cu2O + 2H2O + R-COOH
positive Silberspiegelprobe (= Tollensreaktion): 2Ag+ +2OH– + R-CH=O → 2Ag + H2O + R-COOH
→ Glucose ist ein Aldehyd
Die Schiff’sche Probe fällt dennoch negativ aus, da sie im sauren Milieu abläuft und so eine Ringöffnung nicht möglich ist.
- b) Reduktionseigenschaften
Glucose ist eine Polyhydroxyverbindung (tiefblauer Komplex mit Kupfer(II)Ionen), welche als Aldehyd seinen Reaktionspartner reduzieren kann (siehe z.B. bei der Fehlingprobe). Glucose selbst wird dabei oxidiert.
- c) Glucose in der Fischer-Projektion

- → Aldose → Glucose ist eine Aldohexose
- Polyhydroxyalkohol

- OH-Gruppe rechts → D-Glucose

Vorstellung für die Fischerprojektion: Die Kohlenstoffkette (hier am Beispiel von D-Glucose) wird um eine Rolle gewickelt, dabei zeigen die Substituenten nach vorn, von der Rolle weg.
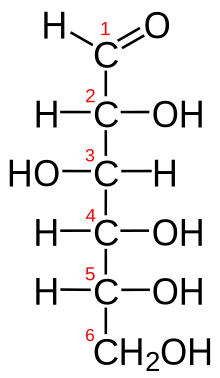
Zum Erstellen der Fischerprojektion (nach Emil Fischer, 1891) ordnet man die Kohlenstoffe senkrecht an und zwar so, dass der am höchsten oxidierte Kohlenstoff (also der mit der höchsten Oxidationszahl!) oben steht. Das muss nicht zwangsweise das C am Ende der Kette sein!
Die weiteren Substituenten werden an das Ende von waagerechten Linien gezeichnet. Die waagerechten Bindungen stehen horizontal und zeigen immer zum Betrachter hin (deshalb verwendet man auch manchmal die Keilform, wie oben).
Dabei entscheidet das unterste Stereozentrum (chirales Kohlenstoffatom), ob es sich um die D-Form (OH-Gruppe ist rechts am chiralen Kohlenstoff) oder L-Form (OH-Gruppe ist links am chiralen Kohlenstoff) handelt.
Die Kohlenstoffatome werden übrigens oft gar nicht gezeichnet (siehe rechts). Sie befinden sich logischerweise an den Schnittpunkten der vertikalen und horizontalen Linien.
Zusatzinformationen:
Wie unterscheiden sich D-Glucose und L-Glucose?

- d) Optische Eigenschaften von Glucose
V: Eine D-Glucoselösung wird in einen Polarimeter gehalten.

B: Die Polarisation (Schwingungsebene) des Lichts wird gedreht.
S: Glucoselösung ist optisch aktiv. Liegt eine reine Lösung vor, so dreht sie die Ebene des Lichts.
- → Informiere Dich, was polarisiertes Licht ist (siehe auch die Links unten).
- Vergleich mit dem einfachsten Zucker (Glycerinaldehyd)
- Stäbchenmodell
- Fischer Projektion
- Spiegelbildisomer, Enantiomere liegen vor
Chiralität = Händigkeit
- Oberstes Prinzip: Bei vier verschiedenen Substituenten liegt eine Asymmetrie bezüglich der Substituenten vor → diese Verbindung ist (zu 99%) optisch aktiv.
- Licht einer Polaristationsebene (z.B. aus einem Polarimeter) wird durch eine D-Glucose-Lösung gedreht. Je nach Drehrichtung wird der Zucker dann D-(+)- oder D-(-)- Glucose genannt. Auch von der L-Glucose gibt es eine + und eine - Form.
- Drehung des Lichts nach + oder - ist nicht gleich D oder L!!!
- Ein Gemisch auch Mischung D,L Glucose (1:1 - wird Racemat genannt) ist nicht mehr optisch aktiv.
In der Medizin wird der so genannte GOD-Test (Glucose-Oxidase Test) eingesetzt. Durch ihn wird durch ein Enzym die D-Glucose nachgewiesen (Teststäbchen).
D-(+)-Glucose = Dexter - (+) – Glucose (natürliche Glucose)
Zusatzinformation: Polarimeter
Wiederholung: Die Fehling'sche Lösung als Aldehydnachweis
Der Chemiker Hermann von Fehling bemerkte einen Erhitzen von Aldehyden einen orangerot gefärbten Niederschlag, wenn dies vorher mit seiner nach ihm benannten Fehling Lösung (alkalische Lösung eines Kupfer(II)-Tartrat-Komplexes) versetzt wurden.
V: Zu Glucose wird Fehling Lösung zugefügt und vorsichtig erhitzt. Fehlinglösung I = Kupfer(ll)-sulfatlösung; Fehlinglösung II = Kaliumnatriumtartratlösung
B: Orangeroter Niederschlag
S: Glucose ist eine Aldose (ein Aldehyd!). Sie reagiert mit der Fehlinglösung in einer Redoxreaktion und oxidiert dabei zur Gluconsäure. Gleichzeitig wird das Cu2+-Ionen zu Kupfer(I)-oxid (Cu2O) reduziert.
- Oxidation
- Eine Aldehydgruppe wird im basischen zur Carbonsäure oxidiert.
- Da die Reaktion in alkalischer Umgebung stattfindet, wird die entstehende Carboxygruppe durch Hydroxidionen zur Carboxylatgruppe im Sinne einer Säure-Base-Reaktion deprotoniert
- Reduktion
- Kupfer(II)-ionen und Hydroxidionen reagieren zu Kupfer(I)-hydroxid, das weiter zu Kupfer(I)-oxid dehydratisiert.
- Redoxreaktion
- Kupfer(II)-ionen und Aldehydgruppen reagieren im basischen Milieu zu Kupfer(I)-oxid, Carboxylaten und Wasser
- Merke
- Oxidation des Aldehyds zur Carbonsäure
- Reduktion von blauen Kupfer(II)-ionen zu rotem Kupfer(I)-oxid
Reduzierende Eigenschaften von Glucose
Glucose zeigt reduzierende Eigenschaften (Nachweis durch positive Silberspiegelprobe oder Fehlingprobe). Die Schiff’sche Probe hingegen verläuft negativ, da in wässrigen Lösungen die Glucose überwiegend in Ringform vorliegt und somit die Kettenform blockiert ist → es ist kaum Aldehyd vorhanden. Da die Fehlingprobe chemisch sensibler ist, kann sie die geringen Mengen dennoch nachweisen. Die Schiff‘sche Probe hingegen ist vergleichsweise „unsensibel“. Vorliegende geringe Aldehydmengen reichen also nicht für einen positive Schiff‘sche Probe aus.
Glucose ist für viele Tiere der Hauptenergieträger schlechthin. Er wird von Pflanzen bei der Photosynthese produziert und dient in der Natur als Ausgangsstoff für viele weitere Produkte, wie z.B. Stärke oder Zellulose. Viele dieser Produkte werden im Laufe der Verdauung beim Menschen zuerst wieder in Glucose umgewandelt, dann ins Blut aufgenommen und letztlich von den Zellen in der Zellatmung wieder zu Kohlenstoffdioxid und Wasser oxidiert.
Zusatzinformationen: Eindeutige (also spezifische) Nachweise für Glucise (bzw. Fructose liefert für Glucose der Glucoseoxidaseteststreifen, für Fructose die Seliwanoff-Probe.
Aufgaben
- Erstelle die Reaktionsgleichung für eine positive Fehlingreaktion mit Ethanal, Propanal, Aceton.
Versuche zu den reduktiven Eigenschaften
- a) Blaues Wunder (Methylblau und Glucose)
In einem Erlenmeyerkolben oder einem Rundkolben werden 20 g Glucose in 100 ml Wasser aufgelöst. Dann wird solange Methylenblau hinzugefügt, bis die Lösung tintenblau ist.
Dann wird etwas Natronlauge hinzugefügt (10-20 mL einer ca. 1 molaren NaOH oder einfach 3 Pastillen festes Natriumhydroxid). Das Gefäß wird mit einem Stopfen leicht (!) verschlossen - Achtung den Stopfen nicht fest reindrücken!
Nun wird alles auf ca. 40°C mit dem Brenner vorsichtig erhitzt.
B: Die Blaufärbung verschwindet beim Erwärmen - kehrt aber beim kräftigen Schütteln oder Rühren der Lösung zurück.
S: Der Farbstoff Methylenblau ist in seiner oxidierten Form blau. Wird er von Glucose (zu einer farblosen Leukoform) reduziert, verliert er die blaue Farbe (aus Glucose entsteht dabei Gluconsäure). Diese Redoxreaktion läuft im alkalischen Milieu ab.
Wird die farblose reduzierte Form gerührt, kommt er erneut zur Oxidation durch den eintretenden Luftsauerstoff, so dass wieder Methylenblau entsteht.
Der Vorgang ist so lange wiederholbar, bis keine reduzierende Glucose in der Lösung mehr vorliegt.
- b) Reduktion von KMnO4 durch Glucose
Eine Spatelspitze Glucose wird mit 2 mL Wasser und mit einigen Tropfen KMnO4-Lösung versetzt und geschüttelt.
B: Die violette Lösung verfärbt sich braun.
S: Glucose reduziert das violette KMnO4 zu braunem MnO2. Aus Glucose bildet sich Gluconat.
- c) Farben beim Kippen
V: In einem Becherglas werden genau 6,0 g NaOH werden in 200 mL Wasser aufgelöst.
In einem zweiten Becherglas werden 700 mL 36°C warmes Wasser gefüllt und dann 14,0 g Glucose aufgelöst. Beide Lösungen werden zusammen geschüttet und abschließend werden 0,06 g Indigokarmin hinzu gegeben. Nun kann man das Gemisch in ein anderes Gefäß (z.B. einen Eimer) schütten.
B: Die Farbe verändert sich bei Sauerstoffkontakt. Nach einiger Zeit stellt sich die ursprüngliche Farbe wieder ein (grün → rot)
S: Glucose reduziert das rote Indigokarmin, welches sich dadurch grün färbt. Erneuter Sauerstoffkontakt führt zu erneuter Oxidation (→ Rotfärbung).
Eine Besonderheit der Zucker in Wasser - Ringschluss durch Halbacetalbildung
V: Zu Glucoselösung wird Fuchsinschweflige Säure zugefügt (Fuchsinschweflige Säure ist ein nicht ganz so empfindlicher Aldehydnachweis. In Gegenwart eines Aldehyds färbt sie sich violett).
B: Kein Farbumschlag!
S: Da Glucose eine Aldose ist, wie mit der positiven Fehlingreaktion ja auch beweisen wurde, müsste der Nachweis mit fuchsinschwefliger Säure auch positiv verlaufen. Tut er aber nicht! → Die Aldehydgruppe wurde verändert!
Die offenkettige (und dir bisher bekannte) Form der Glucose kommt in Wasser nur mit ca. 0,003% tatsächlich vor! 99.997% der Glucosemoleküle kommen in einer Ringform vor. Sie entsteht durch die innermolekulare (=intramolekulare) Reaktion von Alkoholgruppe und Aldehydgruppe (=Halbacetalbildung). Es findet ein Ringschluss über eine Sauerstoffbrücke statt. Da bei diesem Ringschluss die Aldehydgruppe angegriffen wird (und das Aldehyd C oxidiert wird), liegt zu 99,997% kein Aldehyd vor. Die verbleibenden 0,003% reichen für einen Nachweis der (sensibleren) Fehlingreaktion aus, aber nicht für den Nachweis mit fuchsinschwefliger Säure.
Eine weitere Besonderheit kommt nun durch den Ringschluss zutage:
Da der Kohlenstoff der Aldehydgruppe frei drehbar ist, kann der Ringschluss stattfinden, während das O links oder rechts ist. Demzufolge zeigt es im Ring nach oben oder unten! Man unterscheidet deshalb zwischen einer α- und eine β- Form (bei der α-Form zeigt das OH am ersten C nach unten, bei der β-Form zeigt es nach oben). Der Sechsring wird auch Pyranring genannt (→ bei Glucose: Glucopyranose).

Bitte nicht verwechseln: α- und β-Form sind nicht zu verwechseln mit der D und L Form! Es gibt eine α- und eine β-D-Glucose sowie eine α- und eine β-L-Glucose.
Das Vorliegen in der Ringform in wässrigen Lösungen erklärt auch das Versagen der Schiff’schen Probe. Es liegt zu über 99,9% keine Aldehyd vor!
Die Schiff‘sche Probe ist für derart geringe Mengen (0,003% Aldehyd) nicht empfindlich genug.
Tipp zum Merken der Begriffe Furanose und Pyranose:
Der Mechanismus der Ringbildung
Das anomere C-Atom
Durch den Ringschluss kommt es zu einer weiteren Besonderheit: Ein zusätzliches chirales C-Atom entsteht. Dieses wird als anomeres C-Atom bezeichnet - die an ihm befindeliche alkoholische Gruppe wird als anomere Hydroxidgruppe bezeichnet.
→ Es gibt durch den Ringschluss immer zwei Formen, welche mit α und β bezeichnet werden.
Eine weitere Möglichkeit: Perspektivische Darstellung von Zuckerringen
-
α-D-Glucose
-
β-D-Glucose
Das Phänomen der Mutarotation
Wenn man je reine wässrigen Lösungen von α-D-Glucose und β-D Glucoese im Polarimeter untersucht misst man für α-D-Glucose: + 112° Drehwinkel, für β-D-Glucose: + 19° Drehwinkel. Wartet man nun einige Zeit nach dem Lösen in Wasser von α- bzw. β-Glucose, verändert sich der Drehwinkel bis zu einem konstanten Wert von 53° verändert. Es liegt also kein 1:1-Gemisch beider Formen vor.
→ Es liegt eine Umwandlung der α-in die β-Form vor. Dieses Phänomen nennt man Mutarotation.
Ablauf der Mutarotation
- Durch den Ringschluss entsteht ein neues, (5.) Asymmetriezentrum. Es entstehen 2 Isomere mit unterschiedlicher Stellung der Hydroxylgruppe am C1-Atom.
- keine Spiegelbildisomere, also Diastereomere (nicht Enantiomere).
- Diastereomere, die sich nur durch die Konfiguration am C1 unterscheiden → Anomere.
- cyclische Zucker-6-Ringe bezeichnet man als Pyranosen.
Ab K13 verständlich: Die offene Kettenform und die beiden Ringformen stehen miteinander im chemischen Gleichgewicht. Die Umwandlung der Formen in einander bezeichnet man als Mutarotation.
Wie kommt die Ringbildung genau zustande?

Die Aldehydgruppe am C1 reagiert mit der Hydroxyidgruppe am C5 unter Ausbildung eines innermolekularen Halbacetals[2] → Ringschluss. Es liegt keine Aldehydgruppe mehr vor!
Sessel oder Wanne?
Cyclische Sechsringe unterscheiden sich in ihrer Form. Man kennt die Sesselform und die Wannenform. Das Glucosemolekül liegt v.a. in der Sesselform vor.
-
Sessel
-
Wanne
Aufgabe:
- Warum zeigt die Schiff’sche Probe keinen positiven Nachweis? (Warum funktionieren aber die anderen Nachweise?
Der Nachweis bei der Schiff’sche Probe erfolgt nur über offene Aldehydform! Die Halbacetalgruppe am C1 ist aber sehr reaktiv und kann deshalb zumindest von Ag+ und Cu2+ Ionen oxidiert werden. → Silberspiegelprobe positiv
Die Haworth-Projektion zur Darstellung von Zuckern
Ringförmige komplexe organische Moleküle können sehr übersichtlich nach der Haworth-Formel dargestellt werden (benannt nach dem Chemiker Walter Norman Haworth)
Regeln für die Umwandlung der Fischer in die Haworthprojektion:

Regeln zur Erstellung
- Das Molekül wird als ebenes Sechseck (bzw. Fünfeck) gezeichnet
- ein im Ring enthaltenes Sauerstoffatom wird so eingezeichnet, dass es bei Fünfringen vom Betrachter weg zeigt, bei Sechsringen kommt es in die hintere rechte Ecke
- Die Kohlenstoffatome werden im Uhrzeigersinn nummeriert
- Substituenten werden mit einer Senkrechten Linie ober- bzw. unterhalb des Rings gezeichnet
- Substituenten, die in der Fischer-Projektion nach rechts zeigen, werden in der Haworth-Projektion nach unten eingezeichnet, Substituenten, welche nach Links zeigen entsprechend nach oben.
Anmerkung: In der Haworth-Projektion kommt der gewinkelte Bau des 6-Ringes nicht zum Ausdruck. Monosaccharide, wie Glucose liegen nicht eben (planar) vor, sondern meist in Sesselkonformation.
Eine schematische Darstellung der Glucose
-
Alpha-D-Glucose
-
Beta-D-Glucose
Zusatzinformationen:
Halbacetalbildung bei Glucose im Detail
Fruchtzucker - Fructose - C6H12O6 - eine Hexose

Fructose ist eine 2-Ketohexose.
V: Aus der Literatur kann man entnehmen, dass Fructose einen positiven Ketosen Nachweis zeigt (Seliwanow-Reaktion positiv). Wie reagiert sie auf typische Aldehydnachweise?
B: Fehlingprobe positv, Silberspiegelprobe positiv
S: Es müssen Aldehyde vorliegen. Diese sind durch Keto-Enol-Tautomerie entstanden.
Vorkommen von Fructose
- vor allem in süßen Früchten und Honig
- Lebensmittel, welche Fructose, gewonnen aus Maisstärke enthalten
- Pollen mancher Pflanzen
Eigenschaften
- Fructose ist schlecht auskristallisierbar, sie bildet statt Kristallen eher sirupartige Flüssigkeiten
- D-Fructose dreht die Schwingungsebene des linear polarisierten Lichts nach links → D-(–)-Fructose.
- am C2-Atom ist eine Ketogruppe → Fructose ist eine Ketose → Aldehydnachweise sollten eigentlich unwirksam sein.
- Fruchtzucker besitzt eine höhere Süßkraft als Glucose
- Aufnahme im Darm ist langsamer als bei Glucose. → Fructose wird nie vollständig aus der Nahrung aufgenommen (meist gut für Diabetiker) → beeinflusst den Blutzuckerspiegel kaum.
- wird vom menschlichen Organismus insgesamt schneller abgebaut als Glucose
- Abbau durch das Leberenzym Fructokinase erst in Fructose-1-phosphat und dann zu Glycerinaldehyd und Dihydroxyacetonphosphat (es folgt eine Phosphorylierung und anschließend steht sie der Glykolyse zur Verfügung (siehe Bio) → Es wird zur Aufnahme kein Insulin benötigt! → zum Süßen für Diabetiker geeigneter als Glucose.
- Fructose in großen Mengen steigert u.U. den Cholesterinspiegel im Blut.
- Es sind 2 verschiede Ringschlüsse möglich: In wässrigen Lösungen liegt Fructose als Sechsring vor (Fructopyranose)[3]
- In Verbindungen liegt es hingegen als Fünfring[4] vor (Fructofuranose).
Zusatzinformation:
- Mit verdünnter Natronlauge werden Mannose, Glucose und Fructose ineinander umgewandelt (durch Keto-Endiol-Tautomerie). Die führt zu einem Gleichgewicht dieser Isomeren. Dies reicht aus, um eine positive Fehlingprobe zu erreichen. Im Grunde wird aber nur Glucose nachgewiesen.
- Nachweis über die Seliwanow-Probe durch Kochen in HCl und Resorcin Zugabe. Dieser Nachweis für Ketohexosen in der Furanose-Ringform findet im leicht sauren Milieu statt, so dass es nicht zu einer Keto-Endiol-Tautomerie kommt. Folglich kann keine Glucose nachgewiesen werden.
- Der Nachweis mit Fehling sollte nicht funktionieren, aber durch Keto-Endiol-Tautomerie erfolgt in geringem Maße eine innermolekulare Umlagerung (über eine nicht isolierbare Endiol-Form) zur Aldehydform (es entsteht also Glucose!). → die Fehlingprobe ist positiv.
Mannose

In Lebewesen kommen immer nur die Enantiomere der D-Reihe vor. Ein weniger bekannter Einfachzucker ist die Mannose. Sie ist ein Hauptbestandteil von biologischen Membranen. Außerdem kommt sie als Baustein in vielen biologischen Polysacchariden vor.
Zusatzinformation:
Vergleich der beiden Fructoseformen (Fructopyranose - Fructofuranose) in ihrer α und β -Form
Aufgaben
- Mit welchem Dir bekanntem Nachweis, kann man Glucose und Fructose voneinander unterscheiden?
Zusatzinformationen:
Galactose (Schleimzucker) (C6H12O6)

Galaktose kommt v.a. in den Schleimhäuten vor. Sie ist entzündungshemmend und hat somit eine heilende (sowie beruhigende) Wirkung.
Wissenswertes
- Galactose gehört zur den Aldohexosen.
- Es existieren wieder vier Formen (vergleichbar der Fructose), jeweils α- und β-Pyranosen und α- und β-Furanosen (also je zwei Sechs- und zwei Fünfringe).
- Es gibt spezifische Drehwerte α-D-Galactopyranose und β-D-Galactopyranose.
- Galactose ist als Baustein in Lactose und anderen biochemischen Stoffen zu finden.
- Galactose ist als Bestandteil in der Muttermilch enthalten.
- Im Dünndarm aufgenommen, wird sie durch das Leberenzym Galaktosinase abgebaut.
- Eine Erbkrankheit existiert, bei der die Betroffenen Galactose aufgrund eines Enzymmangels nicht verdauen können. Dies kommt sofort nach der Geburt zum Tragen.
Zusatzinformationen:
Stammbaum der D-Aldosen
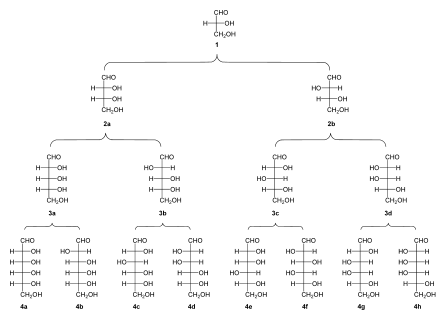 Hexosen verfügen über vier chiralen C-Atome → es gibt 16 verschiedene Aldohexosen!
Hexosen verfügen über vier chiralen C-Atome → es gibt 16 verschiedene Aldohexosen!
Zur D-Glucose existieren also 15 Stereoisomere (ein Enantiomer und 14 Diastereomere). In der folgenden Grafik sind alle acht D-Aldohexosen aufgeführt.
Viele natürliche Zucker sind keine Monosaccharide. Sie bestehen aus zwei miteinander verbundenen Monosacchariden, den Disacchariden.
Durch die Reaktion einer anomeren OH-Gruppe (also der α, β- OH-Gruppe) mit anderen Alkoholen entstehen unter Wasserabspaltung eine Verbindung zwischen zwei Monosacchariden. Rein chemisch gesehen sind dies Acetale. Sie werden auch Glycoside genannt.
Glycosidische Bindung
Beachte:
- Je nachdem, ob die α- oder β-Form eines Zuckers reagiert, entstehen auch zwei verschiedene Glycoside - einmal mit der glycosidische Bindung nach oben und einmal nach unten gezeichnet.
- Da die anomere OH-Gruppe des Zuckers nun fest gebunden ist, können die α- und die β-Form nicht mehr durch Mutarotation ineinander umgewandelt werden.
Man unterscheidet vor allem folgende Typen von Disacchariden:
a) Zweifachzucker aus Glucosemoelkülen:
- Cellobiose,
- Laminaribiose,
- Trehalose,
- Maltose (Malzzucker)
- Gentiobiose
b) Zweifachzucker aus je einem Glucose- und Fructosemolekül:
- Saccharose (Rohzucker)
c) Zweifachzucker aus je einem Glucose- und Galactosemolekül:
- Lactose (Milchzucker)
d) Zweifachzucker aus je einem Fructose- und Galactosemolekül:
- Lactulose (synthetischer Stoff, aus Lactose gewonnen)
Zuckergewinnung für den Haushalt
- Zuckerrüben
- Zerkleinern
- Waschen
- Rübenschnitzel → Reste
- Viehfutter
- Wasserzugabe
- Rohsaft
- Zugabe von Kalkmilch und CO2
- Dünnsaft
- Konzentrieren durch Eindampfen
- Dicksaft → Zuckerrübensirup → Alkoholgewinnung
- Reinigen durch Auskristalisieren
- Rohzucker
- Raffination durch Umkristalisieren
- Kristallzucker
Zuckerverwendung in Deutschland
Maltose (=Malzzucker): Doppelzucker aus 2 α-D-Glucosemolekülen (C12H22O11)

Maltose entsteht z.B. bei der enzymatischen Spaltung von Stärke auf der Zunge bei der sofortigen Verdauung von Stärke bzw. beim Keimungsvorgang vieler stärkehaltiger Getreidekörner sowie Kartoffeln (durch das Enzym α-Amylase). Maltose ist also ein Abbauprodukt von Stärke.
Der erste Schritt der Bierherstellung ist ein Keimen von Gerstenkörnern, welche dann kurz geröstet werden um den Keimungsvorgang zu beenden. Das Produkt wird Malz genannt. Bei der Keimung ist Malzzucker entstanden.
Wie man sieht ist Maltose ein Zweifachzucker aus zwei α-D-Glucosemolekülen. Die Verknüpfung findet über eine glykosidische Bindung zweier Glucosemoleküle (α-1,4-glycosidische Bindung ) mithilfe einer alkoholische OH-Gruppe statt. Dabei wird ein Wassermolekül abgespalten (=1,4-α-glykosidische Bindung).
Maltose hat aufgrund der freien OH-Gruppe am C1-Atom eine reduzierende Wirkung → Fehling-Probe ist positiv
Zusatzinformationen:
Saccharose (=Rübenzucker)
Saccharose ist vor allem als Haushalts- bzw. Kristallzucker bekannt. Sie wird aus Zuckerrüben oder aus Zuckerrohr hergestellt.
Gewinnung
6000 t Zuckerrüben → 800 t Zucker
- Reinigung, Zerkleinerung
- Auslaugtürmeauslaugen des Zuckers durch heißes Wasser: Rohsaft: 12-15%
- Reinigung mittels Kalkmilch (Oxalsäure, Citronensäure, Phosphate, Eiweiß, Farbstoffe)
- Eindicken: 55-65% Zucker → Rohzucker (braun) → Entfärbungsfilter notwendig
Eigenschaften
- Aufgebaut aus je einem Molekül α-D-Glucose und β-D-Fructose.
- → Verknüpfung über eine α,β-1,2-glycosidische Bindung (bzw. α,1-β,2-glycosidische Bindung). Dabei wird Wasser frei.
- Saccharose ist ein nicht reduzierendes Disaccharid → Fehling-Probe negativ (da die Ringe über zwei anomere Kohlenstoffatome eng miteinander verknüpft sind, so dass keine Aldehydgruppe (unter Ringöffnung) gebildet werden kann. Siehe auch „Regel zu den reduzierenden Zuckern“.)
- erst durch Säurezugabe wird die Bindung der beide Zuckermoleküle gelöst
- Smp. 185°C → die Schmelze ist braun und wird auch Karamell genannt. Wird sie weiter erhitzt, verbrennt sie zu „Zuckerkohle“ (auch Zuckercouleur genannt). In dieser Form färbt sie Cola schwarz)
- Saccharose ist gut in Wasser löslich
- Bildung in einigen Pflanzen als Sekundärprodukt der Photosynthese
- 80 Mio t Weltzuckerproduktion
- bis zum 19. Jahrhundert wird Saccharose ausschließlich aus Zuckerrohr gewonnen. Heute verwendet man in Deutschland aber die leichter anbaubare Zuckerrübe. Sie hatte ursprünglich nur einen Saccharose Gehalt von 5% (=Runkelrübe). Durch Züchtungen konnte dieser auf 20% gesteigert werden.
- Saccharose ist die Transportform für Zucker in der Pflanze! Dazu wird die beider Photosynthese entstehende Glucose an ein Fructosemolekül gebunden. Am Ende des Transportes, wird die Fructose wieder abgelöst und steht für weitere Transportvorgänge zur Verfügung.
Inversion der Saccharose
Saccharose dreht im Polarimeter polarisiertes Licht nach rechts, das aus Saccharose nach hydrolytischer Spaltung in saurer Lösung entstandene Produkt links:
- C12H22O11 + H2O → C6H12O6 + C6H12O6
- (+)-Saccharose (α= +66°) und Wasser reagiert zu D-(+)-Glucose (α = +52°) und D-(-)-Fructose (α = -92° = „Invertzucker“ (α = -20°)
Das äquimolare Gemisch aus Aldohexose und Ketohexose nennt man „Invertzucker“. Der Drehwinkel beträgt -20°.
Bedeutung der Inversion
- Bei Bienen produziert das Enzym „Invertase“ im Bienenmagen so Honig
- Industriell: Kunsthonigherstellung (Spaltung mit Wein- oder Citronensäure)
Reaktionsverhalten der Saccharose
Saccharose ist nicht reduzierend → Fehlingsche Probe verläuft negativ.
- Erklärung: Beide anomeren C-Atome (C1 der Glucose, C2 der Fructose) sind durch die Glycosidbindung blockiert → keiner der beiden Bausteine kann reduzierend wirken.
Zusatzinformationen:
Lactose (Milchzucker) (C12H22O11)
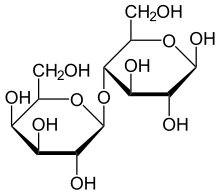
- zu 5% in Milch enthalten
- wird von Milchsäurebakterien in Milchsäure oxidiert
Eigenschaften
- reduzierend
- β-1,4-glycoisidische Bindung
- optisch aktiv
- kristallin
- weniger wasserlöslich als andere Zucker
- farblos
- unterstützt die Calciumionenaufnahme ins Blut
- hemmt Fäulnisbakterien im Darm des Menschen
- wirkt abführend
Lactose ist ein Bestandteil der Muttermilch und somit für Säuglinge sehr wichtig.
Das Enzym Lactase spaltet Milchzucker bei der Verdauung in die beiden Einfachzucker Galactose und Glukose. Dies funktioniert nicht bei allen Menschen gleich gut. Die Enzymbildung ist auch Altersabhängig - nur in Europa und bei einigen afrikanischen Völkern hat sich eine Mutation durchgesetzt, durch die auch erwachsene Menschen Lactose aufspalten können.
Der Enzymmangel wird als Lactoseintoleranz bezeichnet.
Cellobiose (C12H22O11)

Die Cellobiose ist die Baueinheit der Cellulose. 2 β-Glucosemoleküle sind über eine β 1-4 -glycosidische Bindung verknüpft.
Sie entsteht beim Abbau von Cellulose
- reduzierend (→ Fehling Probe positiv.)
- Mutarotation
- Grund: das anomere C-Atom am „zweiten“ Glucose-Molekül ist noch frei, → Umlagerung in Kettenform möglich → Fehling Probe positiv)→ kann α- und β-Form annehmen (→ Mutarotation)
- Unterscheidung
- reduzierende Doppelzucker: Maltose, Cellobiose
- nichtreduzierende Doppelzucker: Trehalose (1→1-α), Saccharose
Bei nichtreduzierenden Zuckern ist die OH-Gruppe an C1 blockiert → keine freie Aldehydform mehr möglich
Übersicht Zucker und ihre reduzierende Wirkung
Einige Zucker können selbst leicht oxidiert werden. Dies sind vor allem die Aldose. Dabei wird deren Aldehydgruppe zur Carbonsäure oxidiert. Der Reaktionspartner wird entsprechend reduziert. Man spricht dadurch von den reduzierenden Eigenschaften der Zucker.
Manchmal ist die Aldehydgruppe nicht sichtbar und der Zucker hat dennoch eine reduzierende Wirkung. Dann sind innermolekulare Umlagerungen (Keto-Enol-Tautomerie oder Muttarotaion dafür verantwortlich).
Ketosen können im Allgemeinen nicht reduzieren!
Bei Disacchariden liegt nur dann eine reduzierende Wirkung vor, wenn eine Aldose vorliegt, die noch Mutarotation betreiben kann.
| Zucker | Fehling/Tollens | reduzierende Wirkung | Grund |
|---|---|---|---|
| Glucose | + | + | Aldose → reduzierend |
| Fructose | + | + | Macht in Lösung zu einem geringen Anteil eine Umwandlung in Glucose durch. → reduzierend, obwohl eigentlich keine Aldose vorliegt |
| Galactose | + | + | Aldose → reduzierend |
| Lactose | + | + | * Lactose besteht zwar aus zwei Aldosen, aber nur die β-Glucoseeinheit kann Mutarotation betreiben, da deren C1 nicht glycoisidisch gebunden ist und sich so in die offene Kettenform umwandeln kann.
|
| Lactulose | + | + | * Galactose ist über die funktionelle Aldehydgruppe verbunden. Es kann keine offene Kette entstehen.
|
| Maltose | + | + | * reduzierend! |
| Cellobiose | + | + | * reduzierend |
- → Saccharose ist kein reduzierender Zucker
Zusatzinformation: Reduzierender Zucker
Wie erkennt man reduzierende Disaccharide?
a) reduzierende Dissaccharide
Am Beispiel des reduzierenden Disaccharides Maltose erkennt man dass bei dessen Bildung eine 1,4-glykosidische Bindung entsteht. Die Konsequenz ist, dass am rechten Zucker noch ein freies Halbacetal vorliegt. Immer, wenn das der Fall ist, dann ist ein Zucker reduzierend.
Dies kann man immer dann voraussetzten, wenn eine 1,4 glykosidische Bindung vorliegt.
→ reduzierende Zucker haben das Halbacetal behalten.
Bei Maltose sind zwei α-D-Glucose-Moleküle über eine halbacetal- und OH-Gruppe unter Wasserabspaltung acetalartig miteinander verknüpft (1,4-α-glycosidische Bindung).
→ Alle Disaccharide, welche die 1,4-Glycoisidische Bindung behalten sind reduzierend.
Bei reduzierenden Disacchariden ist übrigens mindestens ein anomeres Kohlenstoffatom nicht an der glycosidischen Bindung beteiligt.
Was genau ist der Grund für die reduzierende Wirkung bei der Fehling-Reaktion?
Acetale können nur durch Säure und nicht durch Laugen/Basen gespalten werden.
Die glycosidische Bindung wird also von der Fehling'schen Lösung nicht angegriffen.
Aber, das Halbacetal der freien OH-Gruppe kann gespalten werden. Daher reagieren reduzierende Zucker mit einem freien Halbacetal mit der Fehling'schen Lösung.
b) Nichtreduzierende Dissaccharide

Bildet sich aber eine andere Verknüpfung, wie im folgenden Beispiel eine 1,5 glykosidische Bindung, oder wie im Falle der Saccharose eine 1,2 glykosidische Bindung, so liegt an keinem Ende des Dissahraides ein Halbacetal vor. Solche Disaccharide sind nicht reduzierend.
Nichtreduzierende Zucker sind Acetale und haben kein freies Halbacetal mehr.
Bei nichtreduzierenden Disacchariden sind die beiden anomeren Kohlenstoffatome direkt miteinander verbunden.
Polysaccharide - Vielfachzucker (C6H10O5)n
Vielfachzucker sind biologisch bedeutsame Moleküle. Sie tauchen in vielen Lebewesen als Speicherstoff oder Aufbau- und Gerüststoff auf. Aufgrund ihrer Größe und der Tatsache, dass sie auch oft mehr als 5000 Atomen bestehen, nennt man sie auch Makromoleküle.
Da sie aus Monomeren (Einzelzuckern) und Dimeren (Zweifachzuckern) aufgebaut sind, lassen sich Polysaccharide (also Polymere) gut klassifizieren.
Polysaccharide sind aus 100 bis zu mehr als 10 000 Monosaccharidmolekülen zusammengesetzt.
→ Typische Zuckereigenschaften wie Wasserlöslichkeit, Reduktionsvermögen und der süße Geschmack gehen verloren.
Stärke (C6H10O5)n
Wichtigster pflanzlicher Reservestoff (Speicherung in Pflanzenzellen in Leukoplasten) Stärke ist osmotisch unwirksam, d.h. unlöslich in H2O → die Pflanze wandelt die in der Photosynthese entstehenden Glucose in Stärke um, so dass bei einer Speicherung nichts durch Regen- oder Bodenwasser verloren geht. Aufgebaut ist Stärke aus α-D-Glucose-Einheiten.
Der Aufbau der Stärke aus ca. 20% Amylose und ca. 80% Amylopektin:
-
Amylose
-
Amylopektin
| Amylose: (gr. amylum = Stärke) | Amylopektin |
|---|---|
| löslich in heißem Wasser (bildet aber in hoher Konzentration den so genannten Stärkekleister - kolloidale Lösung) | wasserunlöslich |
| aufgebaut aus α-1,4 glycosidisch verknüpften α- Glucose-Einheiten (wie Maltose) | an Verzweigungsstelle zusätzlich 1,6-α-glycosidische Bindungen. (~ alle 25 Glucosemolekülen) |
| entspricht einer Amylosekette mit 20 zusätzlichen Verzweigungen aus bis zu 60 Glucose-Einheiten (hier ist die 1,6-Verknüpfung!) | |
| aus 250-500 Glucosemonomeren aufgebaut | aus mehr als 2000 α-Glucose-Einheiten aufgebaut → verzweigte Spiralen |
| spiralartig | durch Verzweigungen sind keine „perfekten“ Spiralen vorhanden. |
„Stärke“ - Nachweis mit I2/KI-Lösung

Iodzugabe färbt Stärke blau. Der Grund ist, dass Iod (eigentlich (I5)--Ionen) eine blaue Einschlussverbindung bildet.
→ mit Amylose entsteht eine tiefblaue Farbe
Abbau von Stärke =
durch Säure: → Dextrine → Maltose → Glucose
Dextrine werden auch beim Erhitzen der Stärke (backen → Brotkruste) gebildet.
Durch das Enzym Amylase: → Maltosebildung in Mund, Magen und Darm
→ im Darm spaltet das Enzym „Maltase“ dann die Maltose in Glucosemoleküle
Zusatzinformationen:
Amylosekette
Eine Schlaufe besteht aus ca. 6 Glucose Einheiten

Abbau von Stärke
Stärke + α-Aymlase → Maltose + Maltase → Glucose
Glycogen (die so genannte „Tierische Stärke“)

Glykogen ist ein (ähnlich dem Amylopektin) verzweigtes Polysaccharid. Es besteht aus 25.000-90.000 Glucoseeinheiten. Es liegt wie beim Amylopektin eine α-1,4-glykosidischen Bindung mit weiteren α-1,6-glykosidische Verknüpfung vor.
Es gibt aber einige Unterschiede:
- Die Seitenketten sind stärker verzweigt.
- Die Ketten bestehen aus 12-18 Glucoseeinheiten.
- Im Zentrum ist ein Protein (nicht eingezeichnet!) (Glykogenin), von dem Seiten Ketten abgehen, die wiederum verzweigen, wodurch das Molekül baumartig verzweigt.
- Diese kugelförmige Gestalt kann also bei Glucosebedarf im Körper schnell an vielen Stellen abgebaut werden.
Es dient bei Mensch und Tier der Speicherung von Kohlenhydraten. Glykogen ist die Speicherform der Kohlenhydrate in Mensch und Tier und dient der kurz- bis mittelfristigen Speicherung und Bereitstellung des Energieträgers Glucose. In der Leber und in der Muskulatur wird bei einem Überangebot von Kohlenhydraten (hoher Blutzucker-Spiegel) Glykogen aufgebaut.
Bei Hunger, also niedrigem Blutzucker-Spiegel, wird gespeichertes Glycogen abgebaut und in Zucker umgewandelt. Diese Aufspaltung des Glycogens bei vermehrtem Energiebedarf findet in der Leber statt. Der Auf- und der Abbau geschieht durch Hormone. Adrenalin und Glucagon bauen Glykogen ab, Insulin steuert den Glykogenaufbau, also die Umwandlung von Glucose in Glykogen.
Muskelzellen bauen Glykogen ausschließlich zur Deckung ihres eigenen Energiebedarfs ab. Dieser Vorgang wird mit Glykogenolyse bezeichnet.
Eine Säurehydrolyse von Glycogen führt zu D-Glucose.
Zusatzinformationen:
Cellulose (C6H10O5)n
- Hauptbestandteil von pflanzlichen Zellwänden (Massenanteil 50%)
- und damit die häufigste organische Verbindung und das häufigstes Kohlenhydrat der Erde.
- Gerüststoff der Pflanzen
- stets faserige Struktur (Baumwolle, Jute, Flachs, Hanf)
- Aufbau aus 100-10.000 β-Glucose-Molekülen (β-1,4-glykosidische Bindung)
- wasserunlöslich
- kann durch konzentrierte Säuren gespalten werden. Dabei entsteht Glucose
- lineares Makromolekül
- nur von Mikroorganismen abbaubar (Bakterien, Pilze, Ciliaten), welche β-Glucosidasen als Enzym besitzen.
- Abbau: Cellulose → Cellubiose → β-Glucose
Abbau und Verdauung:
Der wesentliche Unterschied von Stärke und Cellulose ist die Verknüpfungsart der Monomere:
- Stärke: α-1,4 glykosidische Bindung
- Cellulose: β-1,4 glykosidische Bindung
Dieser für uns so unbedeutende Unterschied macht es aber aus, dass wir Cellulose nicht verdauen können, da wir kein Enzym haben, welches die Cellulose aufspaltet. Paarhufer (Rinder und Co sowie Unpaarhufer wie Pferde können Cellulose durch besondere Bakterien verdauen).
Die meisten Säugetiere hingegen besitzen keine Verdauungsenzyme für den Celluloseabbau. Sie wird mit der Nahrung, z.B. als Hülse von Hülsenfrüchten und Getreide sowie beim Essen von Salatblättern zwar aufgenommen, aber sie gelangt unverdaut in den Enddarm. Solche Ballaststoffe (dazu gehören auch Pektin und Lignin aus Pflanzen) werden von Darmbakterien anaerob (ohne Sauerstoff) für ihren eigenen Stoffwechsel verwendet. An diesen Bakterien „trainiert“ unser Immunsystem. Einige von Ihnen scheiden als Stoffwechselendprodukt das für Menschen wertvolle Vitamin D aus.
Wiederkäuer, Pferde und Wassergeflügel hingegen nutzen die in ihrem Pansen lebenden Bakterien zur echten Verdauung von Cellulose. Die Bakterien spalten die Bindungen. Der Wiederkauer verdaut dann die aufgeschlossenen Cellulose zusammen mit einigen Bakterien.
- Spezielle Anpassungen zum Abbau im Tierreich
- Wiederkäuermagen
- langer Blinddarm (Pferd) Abbau durch Mikroorganismenals Gärraum
Vorkommen und Verwendung
- in Holz sind bis zu 40 - 50% Cellulose, in Stroh ca. 30% Cellulose enthalten.
- Verwendung als Zellstoff für die zur Papierherstellung
- in der Textilindustrie als Regeneratzellulosefasern (Viskose), Baumwollfasern und Leinen
- in der Baustoffindustrie, als Methylzellulose sowie als Cellophan ((Verpackungs-)Kunststoff aus Cellulose) - z.B. als durchsichtiges Zigarettenpapier.
Aufbau der Cellulose

Lange unverzweigte Ketten aus β-glycosidisch verbundenen Glucosemolekülen Nachweis: Chlor-Zink-Iodlösung → Violettfärbung
Herstellung von Stärkekleister
V: 5g Stärke (Es kann auch Speisestärke oder Maisstärke verwendet werden) werden mit der ca. 4 fachen Menge Wasser vermischt und verrührt. Dieser Brei wird dann in ca. 100mL kochendes Wasser geschüttet. Dabei muss ständig gerührt werden.
Tipp: Zum Erstellen des Stärkekleisters ist es hilfreich lösliche Stärke zu verwenden, da diese im Gegensatz zur normalen Stärke nur aus Amylosemolekülen (weniger Glucose-Enden) besteht.
B: Es entsteht eine durchscheinende, sehr dickflüssige klebrige Lösung. (mindestens Zahnpastakonsistenz).
S: Stärke ist in kaltem Wasser kaum löslich, bei ca. 50°C setzt aber eine Quellung der Stärkekörner ein, welche einen viskosen Stärkekleister bildet, der eine kolloidale Lösung der Stärke ist.
Die Klebwirkung kommt zustande, indem sich die Stärkemoleküle durch das Wasser sehr gut in die in jeder Oberfläche vorhandenen Oberflächenfugen legen. Verdunstet dieses Wasser, hält der Kleister die Oberflächen gut zusammen. Dies klappt besonders gut bei Papier. Weizenstärkekleister war nicht ohne Grund über Jahrhunderte der bevorzugte Leim, um Buchrücken, beim Buchbinden zu leimen.
Stärkekleister und Jod
V: 10ml des weiter verdünnten Stärkekleisters werden im Reagenzglas mit etwas I2/KI-Lösung versetzt und dabei leicht erwärmt. Beim Eintritt der Farbreaktion lässt man alles sofort abkühlen.
B: Beim Erwärmen verblasst die Blaufärbung, bei Abkühlen tritt sie wieder auf (es sei denn, es wurde zu stark erwärmt).
S: Ursache ist, dass die Blaufärbung des Stärkekleisters-Iodkomplexes nur bei Raumtemperatur beständig ist. Bei höheren Temperaturen liegt z.T. aufgrund der stärkeren Molekülbewegung keine Einschlussverbindung mehr vor, dass keine Farbreaktion mehr möglich ist.
Chitin
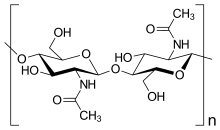
Chitin ist ein Kohlenhydrat und als Baustoff des Insekten Exoskeletts der Cellulose sehr ähnlich. In Pilzen ist Chitin Bestandteil der Zellwand. Seine Funktion entspricht der Zellulose bei Pflanzenzellen.
Chitin besteht als Polysaccharid aus so genannten Acetylglucosamin-Einheiten. Diese sind durch β-1,4-glycosidische Bindungen untereinander verknüpft.
Durch die der Cellulose ähnlich Verknüpfung, kann Chitin also Derivat (Abart) der Cellulose aufgefasst werden, bei der lediglich die OH-Gruppe am C2 durch Acetamido-Gruppen ersetzt wurden.
Diese Substitution einer OH-Gruppe durch eine Acetamido-Gruppe erhöht die Stärke der Wasserstoffbrückenbindung der Polysaccharid untereinander. Deshalb ist Chitin auch wesentlich fester, härter und stabiler als Cellulose.
Natürliches Chitin liegt im Insektenpanzer aber nicht als Reinstoff vor. Es ist ein Gemisch.
Zusatzinformationen:
Weitere Versuche mit Kohlenhydraten
Lugolsche Probe (=Stärkenachweis mit Iod)
Je ein Reagenzglas wird jeweils mit ca. 2-3ml Wasser und einer Spatelspitze Stärke bzw. Glucose-Lösung gefüllt. Dann wird Iod/ Kaliumiodidlösung hinzugefügt.
Enzymatische Spaltung von Saccharose
Eine Spatelspitze Saccharose wird mit etwas Wasser und Hefe versetzt. Die Lösung wird sofort auf zwei Reagenzgläser verteilt. Im ersten RG wird sofort eine Fehling-Probe durchgeführt im zweiten nach ca. 10-15min. Was kann man beobachten? Warum?
Wiederholungsfragen
- Wie kamen die Kohlenhydrate zu ihrem Namen? Wie sind sie heutzutage definiert? Welche funktionellen Gruppen kann man antreffen? Nenne auch die allgemeine Formel (soweit möglich)
- Wie kann man Kohlenhydrate unterteilen? Nenne je Typ mindestens drei Beispiele. Erkläre dann die dazu passenden Regeln der Nomenklatur
- Worauf beruht die süße Wirkung? Sind alle Kohlenhydrate süß?
- Nenne stichwortartig die Zusammenhänge zwischen den Kohlenhydraten der Pflanze und dem menschlichen Körper
- Was ist die Fischerprojektion? Welche Regeln gelten zur Erstellung? Warum ist sie notwendig? Was ist die Haworth-Projektion?
- In welchen zwei Formen kann Glucose auftreten? Unterscheide dabei auch zwischen α- bzw. β-Glucose. Zeichne alle Formen auswendig!
- Wie kann man Glucose nachweisen? Nenne mindestens einen Nachweis mit passender Formelgleichung
- Warum ist die Schiff'sche Probe bei Glucose negativ?
- Was versteht man unter Sessel- und Wannenkonformation?
- Was ist der Unterschied zwischen Ribose und Desoxyribose (Vergleich von RNA/ DNA)
- Die Sättigungswirkung von Polysacchariden ist höher als die von Monosacchariden. Letztere gelangen allerdings schneller bei Nahrungsaufnahme ins Blut. Erkläre die Zusammenhänge.
- Wie unterscheidet sich Fructose von Glucose? Wo sind Gemeinsamkeiten?
- Welche Formen von Fructose gibt es?
- Diabetiker können eher Fructose als Glucose essen, Nenne Gründe
- Bein längeren kauen von Mehrkornbrot entsteht im Mund ein süßlicher Geschmack. Wie heißt der gebildete Zucker und wie heißen die beteiligten Enzyme? Wo geschieht dieser Vorgang sonst?
- Was versteht man unter glykosidischer Bindung?
- Einige Kohlenhydrate sind reduzierend. Die ist ein wichtiges Unterscheidungsmerkmal. Was bedeutet dies und welche Zucker sind reduzierend? Nenne Beispiele
- Stärke ist ein Gemisch. Nenne die Bestandteile und die Unterschiede der beteiligten Stoffe
- Wie funktioniert der Stärkenachweis?
- Was ist die Besonderheit beim Aufbau des Glucogens? Warum ist dieser im Vergleich zur Stärke andere Aufbau sinnvoll?
- Zellulose kann nur von wenigen Lebewesen aufgespalten werden. Nenne Gründe
- Erstelle eine Tabelle in der Du Vorkommen, Aufbau, Spaltungsprodukte, reduzierende Eigenschaften, Nachweise und Verwendungszwecke von Glucose, Fructose, Saccharose, Amylose und Cellulose gegenüberstellst.
- Beschreibe und erkläre den Versuch „blaues Wunder“
- Kann KMnO4 durch Glucose reduziert werden? Wenn ja, erstelle die Reaktionsgleichung
- Was versteht man unter Stärkekleister? Wie stellt man ihn her und wozu wird er verwendet?
- ↑ Oft auch Oligosaccharide (=Mehrfachzucker) aus 2-8 Monomeren genannt. V.a. kennt man aber die Disaccharide wie Maltose und Saccharose
- ↑ Halbacetale bilden sich beider Reaktion von Aldehyden mit Alkoholen.
- ↑ Sechsring = Pyranose; Fünfring = Furanose
- ↑ Fünfringe werden auch als Furan bezeichnet
Fette
Bauprinzip und Funktion von Fetten (Lipiden)
Lipide: Die Dreifachester von Glycerin mit drei meist verschiedenen unverzweigten Monocarbonsäuren (Fettsäuren) werden als Fette bezeichnet. So kommt auch der Name der Verbindungsklasse „Triacylglycerine“ (bzw. Triglyceride) zustande.
- Reine Fette, welche nur aus Glycerin und Fettsäuren entstanden sind, werden gelegentlich auch als Neutralfette bezeichnet (Glyceride). Fettähnliche Verbindungen als Lipoide.
- In der Natur dienen Fette als Polsterstoff für Organe und Muskeln, Wärmeisolierungsstoff und vor allem als Energiespeicher- und Reservestoff (39 kJ/g). Sie haben einen hohen physiologischen Brennwert
- Natürliche Fette sind Mischungen verschiedener Glyceride. Die einzelnen Fettsäuren sind in den Glyceriden regellos verteilt.
- Eigenschaften sind durch den Fettsäureanteil bestimmt.
- Vorkommen in vielen natürlichen Lebensmitteln, z.B. Milchprodukte, Pflanzensamen, Nüsse, Raps, Fleisch- und Wurstwaren usw.
Chemischer Aufbau der Neutralfette aus Glycerin und Fettsäuren
Fette sind Ester des dreiwertigen Alkohols Glycerin mit langkettigen Monocarbonsäuren (=Fettsäuren). Erinnere Dich an das Kapitel Veresterung und das Entstehen von Estern:
Allgemein Veresterung: R1-Hydroxylgruppe + Carboxylgruppe-R2 → R1-R2-Ester + H2O
Bei der Bildung von Fetten liegt nun mit Glycerin ein Dreifachalkohol vor:
 bei R1 = R2 = R3: reine Triglyceride (Ausnahmen in der Natur)
bei R1 = R2 = R3: reine Triglyceride (Ausnahmen in der Natur)
Symbolische Schreibweise für Fette
-
Symbolische Schreibweise für Fette, auch „Skelettformel“ genannt
Fettsäuren sind Bestandteile von Fetten
Fettsäure (FS): unverzweigte Monocarbonsäuren, die Anzahl der C-Atome ist in der Regel geradzahlig, es gibt gesättigte und ungesättigte Fettsäuren (also ohne und mit Mehrfachbindungen)!
Beispiele für gesättigte Fettsäuren
Beispiele für ungesättigte Fettsäuren
Ungesättigte Fettsäuren sind oft pflanzlicher Herkunft. Sie sind für die Ernährung wertvoller und werden nicht so leicht in Körperfett umgewandelt. Einige ungesättigte Fettsäuren sind essentielle Nahrungsbestandteile, sie werden auch als Vitamin F zusammengefasst.
- Ölsäure: CH3(CH2)7CH=CH(CH2)7COOH C17H33COOH

- Linolsäure (=9,12-Octadecandiensäure): CH3(CH2)4CH=CH-CH2-CH=CH(CH2)7COOH C17H31COOH

- Linolensäure (=Octadecatriensäure): CH3CH2CH=CH-CH2-CH=CH-CH2-CH=CH(CH2)7COOH C17H29COOH

Bei natürlich vorkommenden ungesättigten Fettsäuren liegt an Doppelbindungen immer die cis-Konfiguration vor
z.B. Ölsäure: starrer Knick an der Doppelbindung

Vergleich der Schmelz- und Siedebereiche von Fetten und Ölen
Fett enthält ungesättigte cis-Fettsäuren es werden die Fette und die Fettsäuren sich nicht dicht aneinander (parallel) anlagern können die VdW-Kräfte sind nur gering nur geringe Energie ist notwendig die VdW-Kräfte zu überwinden, um die Fette voneinander zu trennen und den Aggregatzustand zu ändern
→ Smp. und Sdp. sind gering.
→ Deshalb haben cis-Fette auch tiefere Schmelzbereiche als die entsprechende trans-Verbindungen
Nachweis der ungesättigten Fettsäuren
→ Baeyersche Probe (Zugabe von leicht alkalischer Permanganatlösung → Entfärbung) → Entfärbung von Bromwasser (Additionsreaktion von Brom an die Doppelbindung)
Iodzahl
Die Menge (Masse) an Iod in g, die von 100 g Fett gebunden wird ist ein typisches Merkmal zur Unterscheidung von Fetten. Ihre Maßeinheit ist [g Iod / pro 100g Fett].
Vergleiche: Iodzahl Butter: 30 - 40: tierisches Fett → geringer Anteil ungesättigter FettsäurenIodzahl Sonnenblumenöl 125 - 136: pflanzliches Fett → hoher Gehalt an ungesättigten Fettsäuren → Anlagerung mehrerer Jodmoleküle
Eigenschaften der Neutralfette
- unlöslich in H2O, löslich in unpolaren Lösungsmitteln → hydrophob = lipophil
- Schmelzbereich statt eines Schmelzpunktes, weil sie in der Regel Gemische sind
- die Konsistenz und die Viskosität von Fetten ist abhängig von a) der Kettenlänge der Fettsäuren und b) dem Gehalt an ungesättigten Fettsäuren (beide Faktoren bestimmen somit über den Aggregatzustand eines Fettes bei Raumtemperatur)
- enthalten Triglyceride bloß gesättigte Fettsäuren mit Kettenlängen > C10, so sind sie bei Raumtemperatur Feststoffe
- Öle sind Triglyceride die mehr als 2/3 ein- oder mehrfach ungesättigte Fettsäuren besitzen
- Öle neigen an Luft zur Autooxidation ( → polymerisieren zu festem Harz)
Chemischer Fettabbau
Durch Verseifung können Fette wieder in Glycerin und die enthaltenen Fettsäuren gespalten werden. (Erinnere Dich, die Verseifung ist die Umkehrreaktion der Veresterung). Dazu kann man einfach Fette mit Alkalilauge erhitzen. Es setzt eine hydrolytische Spaltung der Esterbindungen ein. Es entstehen Glycerin und Alkalisalze der Fettsäuren[1] (= Seifen)
Beispiel: Tripalmitinglycerinester + 3 Kalilauge → 3 Kaliumpalmitat + Glycerin → 3 C15H31COO-/K+
Verseifungszahl
Die Menge (Masse) an KOH in mg, die zur Verseifung von 1000 mg Fett notwendig ist, ist ein Maß für die durchschnittliche Kettenlänge der im Fett enthaltenen Fettsäuren.
Biologischer Fettabbau (durch das Enzym Lipase)
- Fett + Lipase → Glycerin + 3 Fettsäure
- Glycerin → wird für Biosynthesen + weiterverwendet
- Fettsäure → Abbau zu C2-Einheiten → wird für Biosynthesen + weiterverwendet
Bei Energiemangel: oxidativer Abbau (zu CO2 und H2O) zur Energiegewinnung (Umgangssprachlich auch „Fettverbrennung“ genannt)
Versuche mit Fetten
1. Lösungsmittelversuche:
V: Versuche im Reagenzglas verschiedene Fette und Öle in Wasser, Spiritus und Benzin zu lösen. a) Beobachte (wenn vorhanden) auch die Phasengrenze.
b) Was passiert, wenn Du das Reagenzglas leicht bzw. stark schüttelst?
c) Was ist eine Emulsion?
2. Bayersche Probe:
V: Gib zu pflanzlichen Ölen eine leicht alkalische, schwach gefärbte Kaliumpermanganatlösung. Beobachte.
a) Warum kommt es zur Entfärbung
b) Welches Ergebnis erwartest Du bei dem gleichen Versuch, wenn statt Kaliumpermanganat Brom (bzw. Bromwasser) zugegeben wird?
3. Nachweise für Fette I: Die Fettfleckprobe
V: In der Lebensmittelchemie gibt es einen einfachen Test, welcher eine ungefähre Aussage zum Fettgehalt von Lebensmitteln macht. Dazu markiert man einen 2cm, großen Bleistiftkreis auf Papier oder Filterpapier und zerreibt dann Lebensmittel darauf, lässt dies trocknen und hält es dann gegen eine Lichtquelle (z.B. Fenster).
4. Nachweise für Fette II: Die Sudan III Probe
V: Zu Fetten oder Ölen wird etwas Spiritus und Sudan (III) Lösung zugefügt.
5. Nachweise für Fette III: Doppelbindungsnachweis durch Iod (im Abzug durchführen)
a) RG1: In ein Reagenzglas wird etwas festes Iod und eine geringe Menge Essigsäure (ca. 5ml) gegeben. Man wartet, bis sich die Kristalle aufgelöst haben.
b) RG2: In einem zweiten Reagenzglas wird 1ml Olivenöl mit ca. 4ml Essigsäure versetzt. Das zweite Reagenzglas wird nun kurzzeitig vorsichtig erhitzt (Vorsicht - Entzündungsgefahr).
c) Aus dem ersten Reagenzglas werden vorsichtig einige Tropfen der Iod-Essigsäurelösung zur zweiten Lösung gegeben. Nach jedem Tropfen wird geschüttelt. Beobachte genau
6. Oxidative Fettumwandlung (Ranzigwerden)
Vorversuch: Stelle „altes Fritteusenfett“ her, indem Du Pflanzenöl im Verbrennungsschälchen (kein Glaskolben!) ca. 5 min im Abzug erwärmst - Vorsicht, auf Selbstentzündung achten. Vorher also dringend eine Abdeckung, z.B. ein noch intaktes Drahtnetz bereitlegen.
V: Gib zu altem jeweils 5g Fritteusenöl, neuem Sonnenblumenöl und bei Bedarf auch anderen Fettsorten je 20ml Benzin und einige Tropfen Phenolphtalein.
In so zubereiteten Lösungen tropfst Du nun aus einer Maßpipette (oder wenn vorhanden einer Bürette) solange Natronlauge zu, bis sich der Indikator rosa färbt. Das zugegebene Volumen an Lauge wird notiert.
a) Warum ist der „Laugenverbrauch“ bei dem benutzten Fritteusenöl so hoch? Stelle Vermutungen über die Gründe an.
b) Welche Aussagen bezüglich der gesundheitlichen Wirkung solcher Öle kann man treffen?
Vergleich der Entfärbungsreaktionen
V: a) Elektrophile Addition von Br2 an eine Doppelbindung
b) Bayer-Probe (oxidative Spaltung von Doppelbindungen) → Aldehyde – Dicarbonsäuren kürzerer Kettenlänge
| Entf. v. Bromwasser | Bayer-Probe | |
| Leinöl | ||
| Olivenöl | ||
| Palmin | ||
| Schweineschmalz | ||
| ... |
Fetthärtung und Margarineherstellung
Margarine besteht aus gehärteten und ungehärteten Pflanzenölen und Wasser. Normalerweise ist sie als Emulsion weiß, industrieller Margarine werden aber Karotine zugefügt, damit sie eine „gesündere“ gelbliche Farbe hat.
Margarine enthält vor allem gehärtete Fette, also Fettsäuren, an deren Mehrfachbindungen Wasserstoffe addiert wurden. Dabei entstehen auch so genannte Transfettsäuren, welche unter Umständen das Infarktrisiko erhöhen. Bei Palm- oder Kokosfett- bzw. Reformmargarinen wird auf gehärtete Fette verzichtet, somit können auch nicht die gesundheitlich bedenkliche Transfettsäuren enthalten sein.
Der Energiegehalt von Margarine ist mit ca. 750 Kilokalorien pro 100 Gramm genauso hoch wie der von Butter.
„Margarine für die menschliche Ernährung“
In Dürre- und Kriegszeiten hatten die Menschen Europas besonderen Bedarf an Fetten. Fette sind aber teuer gewesen und als Öle auch schwer zu transportieren (die meisten natürlichen Fette sind bei Raumtemperatur flüssig). Es gab also das Problem, flüssige Öle in feste Fette zu überführen.
Napoleon III rief 1864 zu einem Wettbewerb auf, der zum Ziel hatte, einen Ersatz für die teure Butter zu finden. Der Franzose Mège-Mourès fand 1869 die Butter-Alternative: Margarine aus Wasser, Milch und Rindertalg (und etwas Lab). Er nannte sein Produkt Oleomargarin (von lat. oleum = Öl und griech. margaros = Perlmuschel aufgrund der Farbe des Produkts)
Schon 1871 kam es durch die holländischen Familien Juergens und van den Bergh zu ersten Fabriken in Kleve und Goch am Niederrhein. Anstelle von Milch wurde nun auch Schweineschmalz, Walöl, Palmöl, Erdnuss- und Kokosnussfett verwendet.
Fetthärtung durch Hydrierung nach W. Normann, 1902
Eine Hydrierung ist die Addition von Wasserstoff an Mehrfachbindungen. Dazu muss das Wasserstoffmolekül (H2) erst in zwei einzelne Atome gespalten werden, was sehr viel Energie[2] voraussetzt, so dass Hydrierungen in der Regel nicht ohne Katalysator stattfinden.
Aufgrund der hohen Stabilität des Wasserstoffmoleküls benötigt man für die Durchführung der Hydrierung in der Regel einen Katalysator.
Wilhelm Normann hydrierte 1901 erstmals ungesättigte Fettsäuren und lieferte so einen wesentlichen Beitrag zur preiswerten Margarineherstellung. Durch dieses Verfahren werden an die Doppelbindungen der flüssigen Öle Wasserstoffe angelagert. Man spricht auch vom „sättigen“ der Doppelbindungen. Die Moleküle werden dadurch gradliniger und es bilden sich stärkere Van der Waals-Kräfte aus. Die Folge ist eine höhere Anziehungskraft unter den Molekülen, was ihre Eigenbewegung einschränkt, so dass es somit zu einem Anheben des Schmelz- und Siedepunktes kommt. Man erhält mithin bei Raumtemperatur in der Regel ein festes Fett.
Zum Ablauf der Reaktion ist eine Nickelkatalysator notwendig und eine Temperatur von 120-180°C. Wasserstoffgas muss im Überschuss mit einem Druck von mindestens 5bar zugefügt werden.
Fetthärtung findet durch katalytische Hydrierung der Doppelbindungen mit einen Ni-Katalysator bei ca. 180°C, 5bar Druck statt
Zusatzinformationen:
- Margarine
- Hydrierung (Fetthärtung und Margarineherstellung)
LK: Bau und Bedeutung von Lipoiden
Phospholipide (Phosphatide) → abgewandelte Triglyceride, z.B. Lecithine (am Aufbau des Nervengewebes beteiligt)
Wichtige Kennzahlen der Fette
- Jodzahl: Menge Jod in g, die von 100 g Fett addiert werden. Maß für den Gehalt an Doppelbindungen.
- Die Jodzahl gibt an, wie viel g Iod von 100 g des untersuchten Fettes gebunden werden.
- Säurezahl: Verbrauch an mg KOH für die Neutralisation der Fettsäuren in 1g Fett. Maß für den Gehalt an freien Fettsäuren.
- Maß für die Konzentration freier Fettsäuren, das angibt, wie viel mg KOH zur Neutralisation von einem g Fett benötigt werden.
- Verseifungszahl: Verbrauch an mg KOH für die quantitative Hydrolyse von 1g Fett.
- Maß für die durchschnittliche Kettenlänge der Carbonsäuren im Ester.
1) Bsp.: Die Jodzahl eines Fettes beträgt 33. Welche Stoffmenge an Glycerintrioleat würde dies entsprechen?
Glycerintrioleat: M(C57H104O6) = 885,445 g/mol
Jod: M(I2) = 253,8 g/mol
Jodzahl 33 → Verbrauch an Jod: m(I2) = 33 g / pro 100 g Fett
n(Trioleat) = 1/3 n(I2) = 0,043 mol
m(Trioleat) = n(Trioleat) * M(Trioleat) = 0,043 mol * 885,445 g/mol
m(Trioleat) = 38,37 g
1b) Welcher Stoffmenge (mol) an Triglycerid der Ölsäure entsprechen diese Jodzahlen?
| Jodzahl | |
|---|---|
| Butter | 33-43 |
| Rapsöl | 97-108 |
| Sonnenblumenöl | 125-136 |
Lösung:
M (C57H104O6) = 885,445 g/mol
M (I2) = 253,8 g/mol
Jodzahl 33 → 0,13 mol I2
→ 0,13/3 mol Trioleat = 0,043 mol
→ 38,37 g Trioleat
| Jodzahl | Trioleat [mmol] | Trioleat [g] | ||
|---|---|---|---|---|
| Butter | 33-43 | 43-56 | 38-50 | |
| Rapsöl | 97-108 | 127-142 | 113-165 | |
| Sonnenblumenöl | 125-136 | 164-179 | 145-158 |
Die Zellmembran als Beispiel für eine Lipiddoppelschicht
- enthält als Bauelemente (Phospho-)Lipide und Proteine und häufig geringe Mengen von Kohlenhydraten. Als Phospholipid kommt oft Lecithin zum Einsatz
- Begrenzt das Zellplasma, die Vakuole und auch Zellorganellen
- Bilden Doppellipidschicht aus, deren polare, hydrophile Enden dem wässrigen Umgebungsmilieu entgegenragen, während die apolaren, lipophilen Schwänze einander zugekehrt sind,
- 6 bis 9nm dick
- Membranen lassen Stoffe (z.B. Wasser und Salze) hindurch. Kleinere Moleküle oft passiv, größere aktiv ( selektiv permeabel)
- Die Außenseite der Zellmembran ist mit verschiedenen Rezeptoren sowie Oberflächenproteinen besetzt.
- Alle Lipide sind gut in Fett und organischen Lösungsmitteln löslich, aber unlöslich in Wasser
Lecithin - Ein Membranlipid

/D.1ester-lipide-palmitinsäure
Membranen bestehen aus einer Lipiddoppelschicht und enthalten Proteine
Dabei unterschiedet man zwei Arten von Proteinen (= Eiweißen): a) Periphere Proteine (=Oberflächenproteine) haften elektrostatisch von außen an der Membran b) Integrale Proteinen sind in die Lipiddoppelschicht eingebunden und zum Teil auch von außen sichtbar. Sie können als Transportproteine (auch Tunnelproteine genannt) einen feinen Kanal bilden, der Ein- bzw. Austritt kleiner Moleküle und von Wasser ermöglicht
Die Umwandlungs- und Bewegungsvorgänge der Membran werden als Membranfluss bezeichnet, da alle Bestandteile zum selben System gehören und frei beweglich sind. Membranen sind nicht statisch und haben keine feste Struktur, sie können sich gegeneinander verschieben.
Wiederholungsfragen
- Wie sind Fette aufgebaut? In welche Gruppen kann man sie unterteilen?
- Welche Bedeutung kommt dabei dem Glycerin zu?
- Was ist der unterschied zwischen Fetten und Fettsäuren?
- Nenne drei ungesättigte und drei gesättigte Fettsäuren. Jeweils eine davon mit der Summenformel!
- Wie unterscheiden sich gesättigte und ungesättigte Fettsäuren? Wie können sie im Labor unterschieden werden? Nenne zwei Nachweise mit entsprechendem Mechanismus.
- Warum spricht man bei Fetten in der Regel nicht vom Schmelzpunkt, sondern vom Schmelzbereich?
- Wovon sind Konsistenz und Viskosität der Fette abhängig? Wie nennt man flüssige Fette?
- Wie funktioniert der sagenumwobene Fettflecktest?
- Kann man mit Iodlösung eine Reaktion bei Fetten hervorrufen? Nach welchem Mechanismus wird eine eventuelle Reaktion stattfinden?
- Was versteht man unter Fetthärtung? Beschreibe dazu auch die Margarineherstellung
- Welche Kennzahlen gibt es für Fette? Wozu dienen sie?
- In welcher Verbindung stehen Zellmembranen mit Fetten? Erläutere den Aufbau einer Biomembran und begründe
- Was sind Seifen? Wie stellt man sie her? Erläutere den genauen Mechanismus
- Welcher Zusammenhang besteht zur Veresterung?
- Was ist der „Tyndal Effekt“?
- ↑ Salze bestehen aus einem Metallion (welches von der Base kommt) und einem Säurerest: R-COO- Na+
- ↑ Dissoziations-Enthalpie (ΔH0) H2→ 2H = 434 kJ/mol
Seifen und Waschmittel
Seifen
Bereits im 5. Jahrhundert vor Christus wurden Pottasche (K2CO3) und Soda (Na2CO3) im Vorderen Orient zur Reinigung benutzt. Die Römer reinigten verschmutzte Wolle mit sich zersetzendem Urin.
Seifen sind im Grunde die Natrium- oder Kaliumsalze von Fettsäureresten. Das heißt, Fettsäuren bei denen das Proton durch ein Na+ oder K+ ersetzt wurde. Solche Seifen werden heutzutage allerdings kaum noch verwendet, da sie erstens alkalisch sind und so Haut und Textilgewebe schädigen und andererseits Rückstände auf Kleidungsstücken hinterlassen (so genannte unlösliche Kalkseifen).
Seife ist leicht biologisch abbaubar.
Zusatzinformationen:
Rezept zum historischen Seifensieden:
V: In Becherglas oder besser einen Erlenmeyerkolben (wegen der Spritzgefahr!) wird etwas Pflanzenfett (3g) und 50 ml 30% Natronlauge gegeben und erhitzt. Dabei muss die ganze Zeit gerührt werden. Damit es nicht so spritzt, kann ein Deckel eines Konservenglases aufgebohrt werden und so durch das Loch gerührt werden.
Vorsicht, die Spritzer sind kochende Natronlauge. Diese führt bei Kontakt mit dem Auge zur Blindheit! Schutzbrille tragen! Im Notfall sofort mit viel Wasser auswaschen, den Lehrer informieren und sofort zum Arzt fahren.
B: An der Schaumbildung der Lösung erkennt man die zunehmende Seifenbildung. Beim Abkühlen wird die Seife dann als Feststoff sichtbar. (zur Beschleunigung kann auch alles in eine kalte Porzellanschale oder ein kühles Becherglas geschüttet werden.)
S: Aus dem Fett ist durch die Reaktion mit Lauge wieder Fettsäure und Glycerin entstanden. Die chemische Reaktion wird auch Verseifung genannt. Es handelt sich um die Rückreaktion der Veresterung. Da dazu das chemische Gleichgewicht auf die „andere“ Seite gebracht werden muss, ist in diesem Fall Wasser kein guter Partner für das Fett. Aus diesem Grunde verwendet man Natronlauge.
Herstellung von Allseife
Seifen sind Salze von Fettsäuren, sie werden durch Spaltung der Fette mit Laugen gewonnen. (auch andere Verfahren möglich).
a) Ein einfaches Rezept zur Seifenherstellung
- 40 mL Wasser
- 4 g NaOH
- 28,2 g Ölsäure oder Margarine
NaOH im H2O auflösen, erwärmen der Ölsäure, dann Zugabe NaOH. Rühren bei geringer Hitze, bis die Seife fest wird (evtl. Zugabe von Kochsalz). (Achtung, bei mehr als 100°C spritzt die Lauge!). Abschließend mit der Hand ein Seifenstück formen.
b) Ein etwas besseres Waschmittel
10 g Fett oder Speiseöl werden mit 5 mL Ethanol in einer Abdampfschale mit kleiner Flamme auf ca. 70°C erwärmt (Schutzbrille! - Vorsicht, Alkoholdämpfe sind hochentzündlich!).
In einem zweiten Gefäß werden in 10 mL Wasser 2 Natriumhydroxidpastillen aufgelöst und ebenfalls erwärmt. Die zweite Lösung wird dann innerhalb von ca. 10 min unter Rühren zur Fettlösung hinzu gegeben und weiter erhitzt (bis zu 15min!) - doch Vorsicht - verklumpt das Gemisch, besteht die Gefahr des Anbrennens. Eventuell etwas heißes Wasser zugeben.
Die Reaktion ist dann beendet, wenn das weiße Produkt gut sichtbar ist und eine Probe davon sich bereits in einem Reagenzglas in Wasser auflöst.
c) Untersuchung von Seife
V: Die hergestellte Seife oder auch eine Kern- oder Schmierseife wird mit Indikatorpapier untersucht.
B: Blaufärben
S: Echte Seifen reagieren alkalisch
Zur Wiederholung: Veresterung im Detail
Die Verseifung als Umkehrung der Veresterung
Die Verseifung ist in den ersten beiden Schritten eine Gleichgewichtsreaktion, im dritten und letzten Schritt aber nicht! Sie läuft im alkalischen Millieu ab:
Zur Seifenherstellung werden anstelle herkömmlicher Ester meist Fette, also Triglycerin-Säureester verwendet. Der genaue Meschanismus verläuft entsprechend (siehe nächste Seite).
Erinnere Dich: Bei Fetten sind an jedem Glycerinmolekül drei Fettsäuren verestert. Die drei fettsäuren müssen dabei nicht gleich sein. Durch geschicktes Mischen verschiedener Fettsäuren (und Öle) lassen sich so die Eigenschaften der Seife beeinflussen (grober oder feiner Schaum, der mehr oder weniger lange hält, Waschwirkung usw.).
Mechanismus der Verseifung von Tri-Glycerin-Carbonsäureestern
Die Verseifung findet in drei Schritten statt.
Bei den Schritten 1 und 2 liegt eine Gleichgewichtsreaktion vor. Es handelt sich bei der Rückreaktion der Verseifung um eine Veresterung!
Verseifung und Veresterung sind Konkurrenzreaktionen
Information zum vierten Schritt „Ausfällen durch Na+-Zugabe“:
Die Fettsäurereste liegen nun als Anion vor und an die lagert sich im festen Zustand in der Regel ein Kation an. Bei der Seifenbildung ist die Reihenfolge im Grunde umgekehrt.
Beim Kochen der Lauge, kommen nach und nach die Na+ - Kationen an die gelösten Fettsäureanionen, binden über eine Ionenbindung und die Seife flockt so als Feststoff aus. Im Grunde ist dies wie die Bildung eines schwerlöslichen Salzes.
Aus diesem Grunde muss man ein Natriumsalz hinzugeben, da man sonst keinen Feststoff erhält.
Was sind Seifen?
Seifen gehören zur Gruppe der Tenside (von lat. Spannen), sie sind Moleküle, welche eine hydrophilen und einen hydrophoben Rest aufweisen und so als „Emulgator“ Fette und Wasser mischen können. Dies geschieht, indem sie die Oberflächenspannung einer Flüssigkeit oder die Grenzflächenspannung zwischen den zwei eigentlich nichtmischbaren Phasen herabsetzen.
Alle Tensidmoleküle haben einen unpolaren und einen polaren Teil. Der unpolare Teil ist eine Kohlenstoffkette:

| Tenside | Beispiele für den polaren Teil |
|---|---|
| nichtionische Tenside | -OH (Alkohol), -O- (Ether) |
| anionische Tenside | -(COO)- (Carboxylat)
-(SO3)- (Sulfonat), -(SO4)2- (Sulfat) |
| kationische Tenside | quartäre Ammonium-Einheit |
| amphotere Tenside | Haben zwei funktionelle Gruppen: z.B. -COO- und eine quartäre Ammonium-Einheit |
Drei Möglichkeiten Tenside herzustellen:
a) Seifensieden (v.a. historisch):
Bei diesem Vorgang werden Fette durch Laugen gespalten. Es entstehen wieder Fettsäuren und Glycerin. Die Fettsäuren reagieren allerdings durch die Lauge sofort weiter zu Wasser und Fettsäureanionen (Fettsäureresten). Diese Reaktion ist die Umkehrung (bzw. die Rückreaktion) der Veresterung. Sie wird Verseifung genannt.
Im Anschluss findet ein „Aussalzen“ statt. Dazu wird z.B. Kochsalz hinzugefügt. Die Natriumionen des Salzes reagieren mit den Fettsäureanionen und flocken als Feststoff aus.
Je mehr Glycerin zu diese Zeitpunkt noch in der Seife enthalten ist, desto „weicher“ ist das Produkt.
Kernseifen werden vor allem als feste Reinigungsseifen und in Zahnpasta verwendet. Schmierseifen werden zum Teil noch in Scheuermitteln verwendet.
b) Neutralisation von Fettsäuren mit Laugen (v.a. historisch):
Im Grunde nur der letzte Schritt. Zu den durch Lauge gebildeten Fettsäurenanionen wird Natrium- oder Kaliumsalz zugefügt.
c) Heutzutage besteht eine dritte Möglichkeit: Hydrolyse von Fetten
Dazu werden Fette in heißem Wasserdampf in Glycerin und Fettsäuren gespalten. Dies ist im Grunde die genaue Rückreaktion der Veresterung, ausgelöst durch eine Temperaturerhöhung (siehe K13 - Prinzip von le Chatelier)
Zusatzinformationen: Tenside
Wirkung von Tensiden
a) Die Oberflächenspannung von Wasser:
V: Stecknadel oder Büroklammer auf Wasser schwimmen lassen, Seife / Spüli zugeben
B: Die Stecknadel (Büroklammer) sinkt.
S: Tenside setzen die Grenzflächenspannung des Wassers herab.
b) Was sind Tenside?
Tenside sind Stoffe, welche ein hydrophobes (wasserabweisendes) und einen hydrophiles (wasserliebendes) Molekülende haben (auch amphiphil genannt). Sie wirken grenzflächenaktiv und waschaktiv. Tenside setzen die Oberflächenspannung des Wassers herab.
Zu den Tensiden gehören z.B. die Anionen der Fettsäuren:
z.B. die Fettsäure „Stearinsäure“:
Ihr Anion mit einem Natriumion verbunden, ein typisches Tensid: Natriumstearat:
c) Was machen Tenside in Wasser?

In Wasser ordnen sich die einzelnen Tensidmoleküle in kleine kugelförmige Aggregate an (mit dem polaren, hydrophilen Ende nach außen und dem hydrophoben Ende nach innen). Diese Aggregate werden auch „Mizellen“ genannt. Man kann durch sie den Tyndall Effekt erklären. Leuchtet man in eine Seifenlösung, so reflektieren die Mizellen einen Teil des Lichts.
Tenside im Wassertropfen

Gleiches passiert übrigens an der Wasseroberfläche. Die Tenside bilden eine dünne Schicht und verringern so die Oberflächenspannung des Wassers (dabei ragen die hydrophilen Enden in das Wasser, die hydrophoben Enden hingegen in die der Luft).

Ist die Konzentration an Tensiden groß, dann kann Luft eingeschlossen werden. Es kommt zur Schaumbildung.
d) Was machen Tenside in Fetten/ Ölen?

In Fetten und Ölen passiert der umgekehrte Vorgang. Das hydrophobe Ende zeigt ins Fett, das hydrophile Köpfchen mit seiner Ladung nach außen.
e) Wirkung als Emulgator

Befinden sich in einem Gefäß Fette und Wasser, bzw. allgemein hydrophile und lipophile Substanzen, so können diese durch Tenside verbunden werden. Das lipophile Tensidende steckt dann im Fett, das hydrophile verbindet sich hingegen mit dem Wasser. Eine Emulsion ist entstanden.
f) Waschwirkung

Beim Waschen entsteht im Grunde eine solche Emulsion. Die Tenside dringen in Fettflecken ein und sprengen diese sozusagen auf. Die losgelösten Fettteilchen bilden dann kleine Tensid-Fett-Kügelchen und bleiben so in der Flüssigkeit, d.h. sie verschmutzen kein anderes Gewebe mehr.
Struktur und Einteilung der Tenside
Die Einteilung der Tenside in Gruppen erfolgt nach der Ladung der polaren Gruppe:
a) Anionische Tenside
- klassische Kern- und Schmierseifen → Alkylsulfate und Alkylsulfonate
b) Kationische Tenside:

v.a. quartäre Ammoniumsalze, z.B.:
- Didecyldimethylammoniumchloridn = 15 bis 17Verwendungin Weichspülern
- Diesterquat n = 14 bis 16
c) Nichtionische Tenside
Alkohol oder Esterreste als polare Gruppen
- Alkylpolyglykolether n= 9 bis 17m = 3 bis 15
- Alkylpolyglucosidn = 7 bis 13m = 1 bis 3
d) Amphotere / zwitterionische Tenside
Besitzen anionische und kationische Endgruppen:
- Betain n = 11 bis 17
Verwendung in Weichspülern Verwendung in kosmetischen Produkten
h) Tyndall Effekt:
V: In zwei Bechergläser, bzw. zwei Glasküvetten wird eine stark verdünnte Seifenlösung gefüllt. Im optimalen Fall sollte man beide Lösungen nicht mehr voneinander unterschieden können.
Eine Unterscheidung kann nun durch einen Diaprojektor gelingen: Der Lichtstrahl wird nacheinander durch beide Gefäße geleitet.
B: In der Seifenlösung wird der Lichtstrahl viel besser sichtbar.
S: Es kommt zur Streuung des Lichts. Dies ist auf eine Brechung des Lichts durch eine Zusammenlagerung von Seifenmolekülen zu Molekülverbänden.
Versuch zur Grenzflächenaktivität von Tensiden
Als Grenzfläche bezeichnet man die Berührungszone zwischen zwei Systemen verschiedener Aggregatzustände oder zwischen zwei nicht mischbaren Systemen des gleichen Aggregatzustandes. Die einzelnen Systeme heißen Phasen.
Phasengrenzflächen gegenüber Luft hingegen heißen „Oberflächen“.
V: Eine Glasscheibe wird mit Stearin benetzt. Dazu wird ein Löffel Stearinsäure (Pulver) auf heißes Wasser geben und so geschmolzen. Die Phase lässt man abkühlen und gießt sie dann auf eine auf eine Scheibe.
Die Scheibe wird nun von beiden Seiten mit Wasser benetzt.
B: Oberfläche der Scheibe: schlecht benetzbar, Wassertropfen perlt ab Unterseite der Scheibe: gut benetzbar.
S: Stearinsäure ist ein Tensid. In der Schmelze orientieren sich die Stearinsäuremoleküle mit dem hydrophilen Ende zum Wasser hin.
Stearinsäure ist grenzflächenaktiv, d.h. sie „vermittelt“ zwischen Phasen unterschiedlicher Polarität. Stearinsäure ist amphiphil = ein Tensid!
V2: Eine Büroklammer wird auf Wasser gelegt, so dass sie schwimmt. Dann wird etwas Spülmittel oder Seife hinzugegeben.
B: Die Büroklammer sinkt sofort:
S: Die Oberflächenspannung des Wasser sinkt, sie reicht nicht mehr aus, eine Büroklammer zu tragen.
Zusatzinformationen:
- Tyndall-Effekt
- Amphotere Tenside
- Kationische Tenside
- Waschmittel
- Oberflächenspannung
- Grenzflächenspannung
- Dispersion (Chemie)
- Detergentien
- Shampoo
- Spülmittel
Versuche mit Seifen
Verhalten von Seifen gegenüber Säuren
V: Wenige mL Kernseifenlösung werden im Reagenzglas mit einigen Tropfen verdünnter Schwefelsäure gemischt.
B: Die Lösung wird trüber
S: Es bilden sich aus den Seifenanionen wieder Fettsäuren:
- R-COO- + H3O+ → R-COOH + H2O
Bildung von (sonst unerwünschten) Kalkseifen
V: Zu etwas Seifenlösung wird hartes Wasser (oder normales Leitungswasser mit Calciumchloridlösung „härter“ machen“) zugefügt. Zusatzversuch: Schütteln!
B: Die Lösung wird trüber. Durch ein Schütteln kommt es zu einer vergleichsweise geringen Schaumbildung.
S: Es entstehen schwerlösliche „Kalkseifen“, also feste Verbindungen aus den Fettsäureanionen und Calciumionen:
- 2 R-COO- + Ca2+ → (RCOO)2Ca(s)
In Gegenden mit hartem Leitungswasser bilden sich so beim Waschen grauen Schlieren auf der Kleidung. Ein großer Teil des Waschmittels ist so unwirksam, so dass man für eine gute Waschwirkung wesentlich mehr Waschmittel verwenden muss.
Durch die geringe Konzentration an freien Fettsäureanionen, kommt es zu keiner bleibenden Schaumbildung.
Seifen sind Emulgatoren:
Zwei Reagenzgläser werden mit Speiseöl und Wasser zur Hälfte vorsichtig gefüllt. In eines der beiden Reagenzgläser wird etwas Seifenlösung zugefügt. Beide werden beobachtet, dann wird geschüttelt und dann ca. 5 min gewartet und erneut beobachtet.
B: Es bilden sich die typischen zwei Phasen, die sich nach dem Schütteln auch schnell wieder entmischen. In dem Reagenzglas, welches die Seife enthält findet die Entmischung nicht so deutlich statt. Es bildet sich vorübergehend eine trübe, einheitliche Phase.
S: Die Trübungen kommen durch noch nicht vollständige Entmischung und durch Lufteinschlüsse zustande. Die Seifenanionen bilden zusätzlich kleine Öltröpfchen, in denen sie mit ihrem lipophilem Ende stecken. Nach außen ragen die hydrophilen Reste, welche sich durch die Ionenladung gegenseitig abstoßen. Stattdessen lagern sich feine Wasserteilchen an. Es bildet sich so mit dem Wasser eine Emulsion.
Schmutztragevermögen
In zwei Reagenzgläser wird einmal Wasser bzw. Seifenlösung gefüllt. Zu beiden wird eine kleine Spatelspitze Ruß (Kohlenstoffpulver) zugefügt. Die Lösungen werden vorsichtig vermischt und dann filtriert.
B: Zu erwarten wären zwei wasserklare Filtrate. Allerdings ist das Filtrat der Seifenlösung deutlich dunkler
S: Die Rußmoleküle werden von den Seifenanionen mit ihrem lipophilem Ende besetzt und so fein verteilt, dass sie letztlich, umgeben von Wasser, durch die Poren des Filterpapiers laufen können (=dispergierende Wirkung von Seifen).
Inhaltstoffe einer handelsüblichen Hautseife
Am Beispiel einer „pH-Haut neutralen“ Seife (pH = 5,5)
- Weizenstärke (Triticum vulgare)
- Di-Natriumsulfobernsteinsäuremonolaurylester (engl.: Disodium Lauryl Sulfosuccinate)
- Kokosfettsäure-2-sulfoethylester (engl. Sodium CocoylIsethionate)
- Stearinsäure
- Palmitinsäure
- Paraffin
- Glycerinmonostearat (engl. Glyceryl Stearat)
- Cetylpalmitat, Cetylalkohol (gleicher Stoff!)
- Wasser
- Lecithin
- Milchsäure (Engl. Lactic Acid)
- Titandioxid
- Panthenol
- Polyethylenglycol (PEG 14 M)
- Duftstoffe
- EDTA Dinatriumsalz
- Aloe vera Konzentrat (Aloe barbadensis)
Zusatzinformationen:
- Stearinsäure
- Palmitinsäure
- Paraffin
- Cetylalkohol
- Titandioxid
- Dexpanthenol
- Lecithin
- Polyethylenglycol
- EDTA
- Echte Aloe
Waschmittel
a) Versuche
V1: pH-Messung
Vergleiche den pH-Wert von verschiedenen Voll- und Feinwaschmitteln
V2) Bleichmittel:
Man gibt ein RG etwas Tinte und in ein anderes eine schwach konzentrierte, angesäuerte Kaliumpermaganatlösung. Zu beiden wird Vollwaschmittel zugefügt.
B: In beiden Reagenzgläsern kommt es zu einer Entfärbung.
S: Die Entfärbung beruht auf dem Vorhandensein von Perboraten, welche das Permanganation zu dem farblosen Mn2+ reduzieren, bzw, die Tinte oxidativ zerstören.
V3) Lehrerversuch: Boratnachweis (1. Weißmacher in Waschmitteln)

In zwei Reagenzgläser gibt man ca. 5mL Methanol (evtl. ist auch Ethanol möglich) und eine Spatelspitze Feinwasch- bzw. Vollwaschmittel. Zu beiden Reagenzgläsern wird etwas Schwefelsäure zugegeben. Dann erhitzt man vorsichtig und entzündet die entweichenden Dämpfe. Vorsicht!
B. Bei einigen Waschmitteln erkennt man eine grüne Farbe
S: Die in Vollwaschmitteln enthaltenen 1. Weißmacher sind oxidierende Borverbindungen (Perborate). Sie bilden mit Methanol den schon bekannten Borsäuretrimethylester, welcher mit grüner Flamme verbrennt. (Siehe auch Methanolnachweis)
V4) Optische Aufheller (2. Weißmacher in Waschmitteln)
Mit etwas Waschmittellösung und einem Pinsel wird auf ein rundes Filterpapier geschrieben. Nach dem Trocknen kann man die Schrift mithilfe einer UV-Lampe wieder sichtbar machen.
V5) Komplexbildner
Eine FeCl3 - Lösung wird mit K(SCN)-Lösung (=Kaliumthiocyanat) vermischt. Dann wird ein wenig Waschmittellösung zugefügt.
B: Die übliche tiefrote Farbe des Eisen(III)-thiocyanat-Komplexes verschwindet.
S: schnell, da Waschmittel Komplexbildner (z.B. das bekannte EDTA) enthalten. Diese Komplexbildner gehen mit den Eisenionen unserer Lösung einen Komplex ein, so dass unser Komplex sein Metallion verliert und farblos wird. Die Komplexbildner sollen üblicherweise Magnsium und Calciumionen aus dem Waschwasser entfernen, um es weicher zu machen (=„Enthärtung“).
b) Was sind Waschmittel?
Waschmittel sind hoch spezialisierte Gemische, welche zum Waschen verwendet werden.
Sie sind meist flüssig, können auch in Pulverform (oder gepresst in Tabs) vorkommen. Sie werden im Allgemeinen zum Reinigen von Textilien verwendet.
Man unterscheidet dabei, je nach Verwendungszweck, mehrere Typen:
- Vollwaschmittel (=Kochwaschmittel), sind vor allem für weiße und stark verschmutzte Wäsche geeignet. Sie enthalten in der Regel Bleichmittel, Temperaturbereich: 30°C-95°C.
- Color- oder Buntwaschmittel sind logischerweise für farbige Wäsche geeignet und enthalten keine Bleichmittel, Temperaturbereich: 30°C-60°C. Sie werden mittlerweile häufiger verwendet als Vollwaschmittel und sind dank neuer Inhaltsstoffe eine gute Alternative.
- Feinwaschmittel werden für besonders delikate und empfindliche Textilien und für die Handwäsche verwendet. Ihr Temperaturbereich liegt bei max. 40°C, da empfindliche Textilien sonst schaden nehmen- Demzufolge enthalten sie weder Bleichmittel noch optische Aufheller, aber um ihre Waschwirkung zu verstärken Enzyme und Seife. Höhere Temperaturen würden die enthaltenen Enzyme denaturieren.
- Spezialwaschmittel für Wolle, Seide, Daunen, Membrantextilien.
c) Allgemeine Inhaltsstoffe von Waschmitteln
Weniger als 5% enthalten:
reine SeifenWaschaktive Substanz, für die Entfernung von in Wasser nichtlöslichen (lipophilen) Stoffen aus dem Gewebe. Seifen verhindern auch zu starkes Schäumen
PolycarboxylateVerhindern Kalkablagerungen in der Wäsche und schützen vor dem grauer werden der weißen Wäschestücke.
Phosphonate (org. Verbindungen der Phosphorsäure) Soweit noch enthalten, verhindern sie die Reaktion der Inhaltsstoffe untereinander und binden zusätzlich Schwermetalle in Form schwerlöslicher Salze.
Schmutzträger Sie halten den abgelösten Schmutz im Wasser, so dass er sich nicht wieder in das Gewebe einfügen kann.
Zu 5-15% enthalten:
Anionische Tenside: Waschaktive Substanzen, lösen Schmutz von den Fasern des Nichtionische TensideGewebes, binden diesen und verhindern so sein erneutes festsetzen
Oxidierende Bleichmittel Entfernen Flecken durch deren Oxidation (klappt gut mit Saft-, Obst-, Tee- und Rotweinflecken)
Zu 15-30% enthalten:
Wasserenthärter: Erzeugen weiches Wasser durch Binden von im Wasser enthaltenen Magnesium- und v.a. Calciumionen und verhindern so die Bildung von Calciumcarbonat und Magnesiumcarbonat (sowie der beiden Hydrogencarbonate). Diese Salze sind für die so genannte Kalkbildung beim Erhitzen von Wasser zuständig. So können Tenside ihre Wirkung besser entfalten. Vor allem Zeolith A und auch Schichtsilikate werden verwendet. So genannte Builder unterstützen diese dabei. Abgesehen vom Waschen, sind Waschmaschinen durch Enthärter auch besser vor erzeugen weiches Wasser Kalkablagerungen geschützt.
Eiweiß zersetzende: Zersetzen Eiweißflecken, indem sie Eiweiße in Aminosäure spalten.
Enzyme und so für die Entfernung von eiweiß- und stärkehaltigen Flecken sorgen (Amylasen spalten Stärke, Lipasen spalten Fette, Proteasen spalten Eiweiße, Cellulasen spalten Zellulose)
Weitere Inhaltsstoffe:
- Bleichmittelverstärker
- Soda (Na2CO3): Unterstützt die Waschwirkung und enthärtet ebenfalls das Wasser
- Silikate: Verstärken die Tensidwirkung, machen die Wäsche etwas „weicher“,Schützen auch das Metall der Waschmaschine vor Korrosion.
- Optische Aufheller: Machen weiß noch weißer, indem sie einen leichten Blauton hinzufügen, der grau und Gelbtöne optisch „neutralisiert“
- Duftstoffe: Damit man es auch gerne kauft
d) Spezielle Inhaltsstoffe von Vollwaschmitteln

Bleichmittel Sie oxidieren nicht entfernbare, farbige Verschmutzungen (Obst-, Wein- oder Blutflecken), häufig kommt dabei Peroxide in Form von Natriumperborat(dimeren) zum Einsatz.
Farbige Substanzen haben häufig ausgeprägte Doppelbindungselektronensysteme. Bei Oxidationen werden diese teilweise aufgelöst und der Stoff verliert seine Farbigkeit. Da es eine simple Oxidation ist, wird die Reaktionsgeschwindigkeit durch Wärme erhöht (RGT-Regel). Deshalb sind Bleichmittel bei höheren Temperaturen effektiver.
Bleichaktivatoren sorgen dafür, dass die Bleichmittel auch bei niedrigen Temperaturen noch wirksam sind.
Optische Aufheller sind leicht bläulich fluoreszierende Farbstoffe, die durch ihre Fluoreszenz gelbe Schlieren weißer erscheinen lassen.
Stabilisatoren verhindern den nach einiger Zeit sonst einsetzenden Zerfall der Inhaltsstoffe, v.a. der recht reaktiven Bleichmittel der Bleichmittel.
Konservierungsstoffe verhindern v.a. in flüssigen Vollwaschmitteln den Bakterienbefall.
e) Spezielle Inhaltsstoffe von Buntwaschmitteln
Farbübertragungsinhibitoren Sie dienen dem Schutz der Textilienfarben.
Nicht enthalten sind logischerweise Bleichmittel, da sonst die Farben schnell verblassen würden.
Zusatzinformationen:
Aufgaben
- Warum sind Seifen eigentlich Salze? (und was waren eigentlich Salze?)
- Worauf beruht die Waschwirkung einer Seife?
- Was sind Tenside und wie unterscheiden sie sich von den klassischen Kernseifen?
- In Regionen mit hartem Wasser, sieht man v.a. auf dunkler Kleidung häufig weiße, waschmittelähnliche Flecken auf der Kleidung. Diese sind kaum auszubürsten. a) Um was handelt es sich und wie lautet die chemische Formel einer solchen Verbindung?b) Wieso treten diese Verunreinigungen auf?c) Warum hilft es in einem solchen Fall (manchmal) mehr, bzw. weniger Waschmittel zu verwenden?
Wiederholungsfragen
- Was sind Seifen?
Was sind Tenside und wozu benötigt man sie?
- Aus Fetten kann man Seife gewinnen. Beschreibe die praktische Vorgehensweise und erkläre dann den Mechanismus genau
- Warum ist der erste Übergangszustand der Verseifung nicht stabil?
- Wie steht die Verseifung mit der Veresterung in Beziehung? Erkläre reversible und irreversible Schritte
- Was sind Tenside? Wie unterscheiden sie sich von Seifen?
- Wie kommt es zur Bildung von Mizellen. Welcher Bezug besteht zur Schaumbildung
- Welche Wirkung haben Seifen in Wasser (bzw. in Öl)?
- Warum sind Tenside Emulgatoren? Wie kommt es zu dieser Wirkung - skizziere.
- Erkläre die Waschwirkung eines Tensids
- Auch bei Seifen kann man einen Tyndal Effekt beobachten. Erkläre wie und weshalb
- Was sind Kalkseifen? Was sind Kernseifen?
- Wie unterschieden sich Waschmittel von Seifen?
- Warum sollte man Buntwäsche nicht mit einem Vollwaschmittel waschen? Welche Alternativen gibt es?
- Welchen pH-Wert haben Seifen bzw. Waschmittel?
- Warum interessiert die Menschen überhaupt der pH-Wert von Seifen?
- Vollwaschmittel entfärben Kaliumpermaganatlösung. Erkläre
- Nach seinem großen Filmerfolg kann Borat nun auch in Waschmittel nachgewiesen werden. Erkläre wie
- Nenne mindestens 10 Inhaltsstoffe von Waschmitteln und erkläre kurz ihre Funktion/ Wirkung
- In einigen Waschmitteln sind Enzyme enthalten. Erkläre warum und was man bei der Wäsche beachten sollte
Aminosäuren, Eiweiß, Enzyme und die Biokatalyse
Ein wenig Chemie: Energiebeteiligung bei chemischen Reaktionen
Bei jeder chemischen Reaktion spielt die Umwandlung von Energie eine Rolle. Entweder wird Energie freigesetzt, die z.B. vorher in den Ausgangsstoffen enthalten war, oder Energie wird zum Ablauf der Reaktion benötigt und somit dem System entzogen.
Bei der Oxidation von Zucker spielt es keinerlei Rolle, ob diese Reaktion im Körper stattfindet oder ob Zucker im Reagenzglas verbrannt wird. Die bei dieser Reaktion freigesetzte Energie ist identisch.
- Zucker + Sauerstoff → Kohlenstoffdioxid + Wasser + E
a) Energiediagramm (exotherme Reaktion)
- EA = Aktivierungsenergie, notwendig zum Auslösen der Reaktion
- ER = Reaktionsenergie (DH), Energieüberschuss, der bei exothermen Reaktionen frei wird
- EG = gesamt freiwerdende Energie
Chemische Reaktionen, die unter Energieabgabe ablaufen heißen exotherme Reaktionen. Die freiwerdende Energie kann dabei als Wärme, Licht oder in anderen Formen vorliegen. Sie wird auch als Reaktionsenthalpie (ΔH) bezeichnet.
Chemische Reaktionen, bei denen ständig Energie zugeführt werden muss, damit sie überhaupt ablaufen, nennt man endotherme Reaktionen.
b) Energiediagramm (endotherme Reaktion)
- Zusatzinformationen
Das freiwillige Ablaufen einer chemischen Reaktion wird durch die Gibbs-Helmholtz-Gleichung vorausgesagt. Sie bestimmt die freie Enthalpie (ΔG), welche nicht mit der Reaktionsenthalpie (ΔH) verwechselt werden sollte. ΔS gibt in dieser Gleichung übrigens die natürliche „Unordnung“ an, die Entropie.
Wenn ΔG < 0 ist, kann die Reaktion freiwillig ablaufen. Solche Reaktionen nennt man exergonisch. Dies ist besonders bei exothermen Reaktionen der Fall, da sie einen negativen Wert für ΔH haben. Endergonische Reaktionen hingegen laufen nicht freiwillig ab.
Zellen wehren sich gegen das Gift „Wasserstoffperoxid“
Im Körper entsteht durch Abbauvorgänge[1] das Zellgift Wasserstoffperoxid (H2O2)
- 2 H2O2 → 2 H2O + O2 + E
→ Abbau des Giftes ist nötig!
Das (Spalt-)Werkzeug der Zelle ist das Enzym Katalase.
Diese Reaktion würde normalerweise erst bei Temperaturen ablaufen, die sonst mit einem Bunsenbrenner erzeugt werden. Im Körper liegen diese Temperaturen aber nicht vor, also ist ein System notwendig, was die hohe Aktivierungsenergie herabsetzt. Das Enzym „Katalase“ ermöglicht dies.
Enzyme & Katalyse - Versuche zur Wirkungsweise von Enzymen
Erstellen der Hefesuspension: Gib den Inhalt eines Päckchens Trockenhefe in ca. 200 mL Wasser. Teile dann die Hefesuspension mit den Schülern am Nachbartisch.
Versuch 1: Mische ca. 15 mL Hefesuspension mit einem Teelöffel Zucker. Miss die Temperatur der Lösung und fülle dann damit ein Gärröhrchen und beginne die Zeit zu messen. Erfasse für ca. 10 min die Menge an entstehendem Kohlenstoffdioxid. Notiere die Beobachtungen und trage die Ergebnisse graphisch auf (die Zeit auf der X-Achse!).
Wie erklärst Du Dir den Verlauf der Kurve?
Wiederhole den Versuch mit Wasser, welches mindestens 10°C wärmer ist (alternativ 20°C)
Versuch 2: Gib in ein Reagenzglas ca. 2 mL Hefesuspension und dann die gleiche Menge an verdünnter Wasserstoffperoxid - Lösung (H2O2). Beobachte die Reaktion und führe die Glimmspanprobe durch.
Versuch 3: Gib in ein anderes Reagenzglas wiederum ca. 2mL Hefesuspension und erhitze diese über dem Bunsenbrenner. Kühle dann das RG unter laufendem Wasserstrahl ab.
Gib anschließend wieder die gleiche Menge verdünnter Wasserstoffperoxid-Lösung hinzu und beobachte. Führe ebenfalls eine Glimmspanprobe durch.
Notiere alle Beobachtungen und erkläre die Ergebnisse.
Auswertung der Enzymversuche
Versuch 1: B: Gasblasen steigen auf. Temperaturabhängigkeit!
S: Hefe setzt Zucker zu Kohlenstoffdioxid und Alkohol um. Dies geschieht durch verschiedene Enzyme in einem Prozess, welcher aloholische Gärung heißt.
- Zucker → Kohlenstoffdioxid + Alkohol + E
Versuch 2:
B: Gasblasen steigen auf.
S: In der Hefe und in der Kartoffel befindet sich das Enzym Katalase, welches Wasserstoffperoxid zersetzt:
- 2 H2O2 → 2 H2O + O2
Versuch 3:
Keine Reaktion!
Enzym werden durch Hitze zerstört (Denaturierung der Proteinstruktur)
Was passiert eigentlich, wenn die Reaktion zum Erliegen kam und man erneut H2O2 zufügt? Geht die Reaktion weiter? Ja, denn der Katalysator hat sich nicht verbraucht! Er nimmt an der Reaktion teil, verändert sich unter Umständen, liegt am Ende aber wieder unverändert vor!
Zusatzinformationen:
Die zeitliche Enzymwirkung
V: Ein Reagenzglas wird zu drei Vierteln mit Hefesuspension gefüllt, das letzte Viertel wird mit 5%iger Wasserstoffperoxidlösung aufgefüllt. Der Stopfen wird sofort aufgesetzt und das Reagenzglas um 180° gedreht und über einer Petrischale eingespannt.
Die Tropfenzahl pro 20s wird gemessen.
Wenn die Reaktion beendet ist, wird das Glas geleert (ohne es umzudrehen) und die Glimmspanprobe mit dem Restgas durchgeführt
Aufbau und Wirkungsweise von Enzymen (nur LK)
- Enzyme
- reine Proteinenzyme
- Proteidenzyme
- Apoenzym (= hochmolekularer Eiweißträger)
- Coenzym („kleine Wirkgruppe“, Nichteiweißkomponente)
- Apoenzym + Coenzym ⇌ Holoenzym
Wenn das Coenzym nicht fest mit dem Apoenzym verbunden ist, spricht man auch von Cosubstrat, z.B.
- 2 H-übertragende Coenzyme (NADH2, NADPH2, FADH2)
- energieübertragende Coenzyme (ATP, GTP)
Vitamine können als Coenzyme fungieren.
- Nomenklatur
- Substrat + Wirkungsweise + Endsilbe „-ase"), z.B.
- Brenztraubensäuredecarboxylase
- Alkoholdehydrogenase spalten 2 H ab
Spezifität von Enzymen
1. Substratspezifität
Ein Enzym kann nur ein ganz bestimmtes Substrat umsetzen.z.B. Maltase (kann nur Maltose umsetzen, nicht aber Cellubiose)
- (NH2)2CO + H2O → CO2 + 2NH3]]
Urease: spaltet Harnstoff hydrolytisch (H2O wird dazugegeben)
- (NH2)2CS + H2O → (NH2)2CS + H2O
Thioharnstoff wird nicht gespalten
2. Wirkungsspezifität (Reaktionsspezifität)
Ein Enzym kann ein Substrat nur in einer ganz bestimmten Weise umsetzen.
- Substrat A + E1 → Produkt B
- Substrat A + E2 → Produkt C
Substrat A muss sowohl in das aktive Zentrum von E1 als auch in das von E2 passen.
3. Besonderheit: absolute Spezifität
(z.B. Urease): Enzym mit Substrat und Wirkungsspezifität
4. Gruppenspezifität
Die Enzyme setzen Substrate mit der gleichen funktionellen Gruppe um, z.B. spalten alle Peptidasen Peptidbindungen (Pepsin, Trypsin, Erepsin), anderes Beispiel: Lipasen = fettspaltende Enzyme.
Räumlicher Bau von Proteinen (=Eiweißen)
a) Grundbausteine der Proteine: die Aminosäuren (AS)
Enzyme bestehen aus Eiweißen. Sie machen ungefähr 10% der Masse einer Zelle aus (Wasser ungefähr 80%, Fette und Kohlenhydrate zusammen nur 2%). Alle Eiweiße sind aus Aminosäuren aufgebaut.
- COOH = Carboxylgruppe (=Säuregruppe)
- NH2 = Aminogruppe

In Proteinen vom Menschen sind 20 verschiedene AS (die sich nur im Rest R unterscheiden) bekannt[3]. 8 AS davon sind essentiell, sie müssen also mit der Nahrung aufgenommen werden. Man kennt aber mittlerweile ca. 250 AS, die aber nicht zum Aufbau von Proteinen genutzt werden.
Der chemische Nachweis, ob in einer Verbindung Aminosäuren enthalten sind, geschieht meistens über den Stickstoff (Indikatorelement für Proteine: sie enthalten außer C, H, O stets auch N).
Aminosäuren sind gut in Wasser löslich.
Zusatzinformationen:
b) Nur für den Chemie Kurs: Stereochemie - die D- und die L-Form
Es gibt, entsprechend wie bei den Kohlenhydraten eine D- und eine L- Form:

Eine weitere Unterscheidung liegt vor, an welchem C die Aminogruppe und die Carboxylgruppe gebunden sind. Ist es das gleiche C-Atom, so wie hier darstellt, nennt man diese Aminosäuren auch α-Aminosäuren. Bei β-Aminosäuren wären COOH und NH2 an zwei aufeinanderfolgenden Cs gebunden. Aber keine Panik, in der Natur kommen nur α-Aminosäuren vor.
c) Vier verschiedene Aminosäuren als Beispiele
-
Phenylalanin (Phe)
-
Glycin (Gly)
-
Cystein (Cys)
-
Alanin (Ala)
Titration von Glycin (nur GK/LK)

d) Glycin, die einfachste Aminosäure

- Aufbau ähnlich der Ethansäure (Essigsäure)
- der korrekte Name lautet Aminoethansäure
- isoliert ist es ein kristalliner Feststoff
- Smp. ca. 230°C (→ starke Wechselwirkungen zwischen den Molekülen)
- bei großer Hitze zersetzt es sich
- wässrige Lösungen sind schwach sauer
- wässrige Lösungen haben nur eine geringe Leitfähigkeit
Bei Glycin liegt bei pH 6 eine Besonderheit vor, es ist ein Zwitterion. Die Carboxylgruppe (COOH) gibt ein Proton ab, welches von der Aminogruppe aufgenommen wird. Dieser besondere Punkt wird isoelektrischer Punkt genannt.
Zwitterion am IEP[4].
Die Verbindung von Aminosäuren zu Peptiden
a) Zwei Aminosäuren verbunden zum Dipeptid
Aufgabe:
- Verknüpfe die Aminosäuren Arg - Lys - und Cys miteinander zu einem Tripeptid.
b) Viele verknüpfte Aminosäuren bilden eine Kette (Primärstruktur)
- Oligopeptide bestehen aus 2-10 Aminosäuren
- 2 AS bilden verknüpft ein Dipeptid
- 3 AS bilden verknüpft ein Tripeptid
- Polypeptide bestehen aus >10 Aminosäuren
- Makropeptide (> 100 AS)
c) Sekundärstrukturen (Faltblatt- & Helixstruktur)
Durch den 109° Winkel zwischen zwei Kohlenstoffatomen sowie zwischen Kohlenstoff- und Stickstoffatomen, kann sich die Aminosäurekette entweder falten (β-Faltblatt-Form) oder schraubig verformen (α-Helix-Form). Beide Formen können in einem Eiweißstrang vorkommen! Man spricht von einer Sekundärstruktur.
Die Sekundärstruktur kommt durch die Ausbildung von Wasserstoffbrückenbindungen zwischen den freien Elektronenpaaren von Stickstoff (aus der NH2-Gruppe) und Sauerstoff (aus der -COOH-Gruppe) innerhalb einer Polypeptidkette zustande.
In Biologiebüchern werden oft nur die α-Helix und das β-Faltblatt als Beispiele für eine Sekundärstruktur genannt. Sie sind tatsächlich die häufigsten und wichtigsten Strukturformen. Tatsächlich gibt es aber viele Variationsmöglichkeiten. So tauchen neben der α-Helix die π-Helix und die 310-Helix, neben der β-Faltblatt die β-Schleife auf. Bereiche, in denen keine definierte Sekundärstruktur vorliegt, nennt man "random-coil".
Schaut man sich ein Protein genauer an, so sieht man, dass in einem Protein in der Regel eine Abfolge der verschiedenen Sekundärstrukturelemente vorliegt (es tauchen also mehrere Sekundärstrukturen in einem Protein auf!).
Dieses komplexe Gebilde, also die Anordnung der Sekundärstrukturelemente, wird als Tertiärstruktur bezeichnet.
d) Tertiärstruktur
Die Schrauben und Faltblätter können natürlich ihrerseits im Raum gewunden, gefaltet oder gedreht sein. (Vergleiche mit dem Glühfaden einer Glühlampe). Man nennt diese Abfolge von Sekundärstrukturen die Tertiärstruktur eines Proteins. Dabei entscheidet bereits die Primärstruktur über die Konformation der Tertiärstruktur. Durch verschiedene Wechselwirkungen, wie kovalenter Bindung, elektrostatischer Wechselwirkung zwischen Ladungen von Atomen, Van-der-Waals-Kräften bzwischen ungeladenen Gruppen kommt es zur „Verformung“ der in Sekundärstruktur vorliegenden Primärkette.
Die Form der Tertiärstruktur ist für jedes Protein charakteristisch und für die biologische Funktion des Eiweißes notwendig. Schon geringe Abänderungen (z.B. durch Einlagerung von Schwermetallen oder durch Erhitzen) können dazu führen, dass ein Protein nicht mehr funktioniert.
Das Entstehen der Tertiärstruktur erfolgt durch innermolekulare Faltung der Polypeptidkette. Folgende innermolekulare Kräfte sind daran beteiligt:
- (stärkste Bindung)
- (Kovalente) Disulfidbrücken[5]
- ionogene Wechselwirkungen und echte Ionenbindungen
- Wasserstoffbrückenbindungen
- Dipol-Dipolbindungen
- Van der Waals-Kräfte
- (schwächste Bindung)
e) Quartärstruktur am Beispiel des Hämoglobins

Sind nun mehrere Eiweißmoleküle zu einem größeren Komplex verbunden, so liegt eine Quartärstruktur vor. Bei manchen Enzymen ist ein bestimmter Abschnitt innerhalb einer solchen Struktur für die chemische Reaktion entscheidend, dieses sog. aktive Zentrum bildet sich dabei nur bei Zusammenlagerung mehrerer Aminosäureketten aus.
Beim Hämoglobin, dem roten Farbstoff der Blutkörperchen sind beispielsweise vier solche Eiweißmoleküle (2 α-Ketten und 2 β-Ketten) , die zusammen mit einem weiteren organischen Stoff (dem Häm) und einem Eisenion für die Bindung des Sauerstoffs im Blut verantwortlich sind.
z.B. Hämoglobin: 2 α-Ketten (141 AS) und 2 β-Ketten (146 AS) → 4 Untereinheiten
Zusatzinformationen:
Wie kommt es zur Faltung der AS-Kette und somit zur enzymatischen Wirkung?

Aminosäuren sind durch Peptidbindungen zu einer Kette verknüpft. Man spricht von einer Primärstruktur. Diese Kette kann der Einfachheit halber als Strich gezeichnet werden. Aus dieser Kette ragen Thio-, Hydroxy- und Aminogruppen heraus. Zwischen den freien Elektronenpaaren können sich Wasserstoffbrücken ausbilden. Auch andere innermolekulare Wechselwirkungen wie Dipol-Dipol-Kräfte und Van-der-Waals-Kräfte spielen eine Rolle. Die Konsequenz ist eine Faltung (Deformation) der Aminosäurekette. Man nennt eine solche einfache Struktur auch Sekundärstruktur.
Die Aminosäurekette kann sich in verschiedener Weise falten und drehen. Es entsteht eine Tertiärstruktur aus verschiedenen Sekundärstrukturen. Wenn ein solches Molekül eine Funktion als Biokatalysator hat, nennt man es Enzym. Dabei gibt es einen Bereich, der biologisch aktiv und daher aktives Zentrum genannt wird. Meist wird auch nur der Umriss oder ein "Cartoon-Schema" der Strukturelemente dargestellt. Eine Quartärstruktur ist ein Enzym, das aus mehreren Tertiärstrukturen (Untereinheiten) besteht.
Übersicht über die proteinogenen Aminosäuren
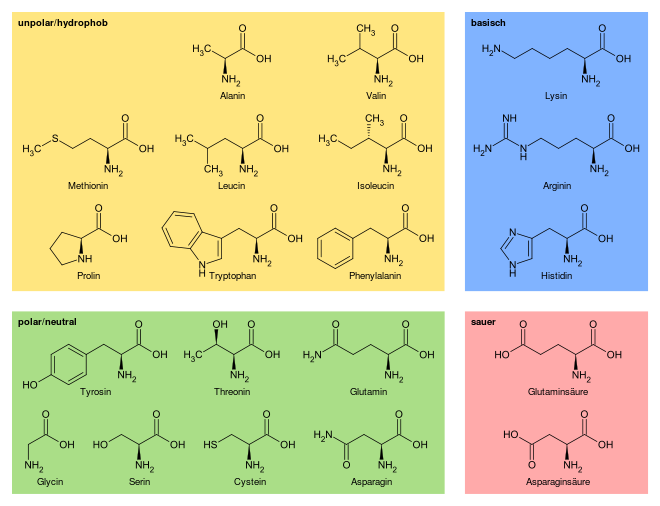
Systematik der Proteine geordnet nach deren Funktion
- Es gibt
- Transportproteine
- Kontraktile Proteine (Actin & Myosin - zu finden in Muskeln)
- Oberflächenproteine
- weitere integrale Zellmembranproteine
- Leberproteine
- Speicherproteine
- Schutzproteine und Schutzenzyme (z.B. Lysozym aus dem Schweiß zersetzt Bakterienwände)
- Enzyme (Biokatalysatoren)
- Hormone (z.B. Peptidhormone der Hypophyse)
- Toxine (z.B. Schlangengifte)
Einteilung der Proteine bezüglich des Baus:
- Faser- oder Skleroproteine (Stütz- und Gerüsteiweiße, wasserunlöslich)z. B. Keratine: Haut- und HautgebildeKollagene: Bindegewebe und org. Knochensubstanz
- Globuläre Proteine (löslich in H2O oder Salzlösung), z.B. Albumine (Bluteiweiß), Globuline (viele Plasmaproteine)
- Proteide (zusammengesetzte Proteine) aus Eiweiß + Nichteiweißkomponente (= prosthetische Gruppe)z.B. Chromoproteide: HämoglobinGlycoproteide: KH + Eiweiß (Speichel, Schleim)
Einteilung der Proteine bezüglich der Funktion:
- Strukturproteine
- Enzyme
- Regulatorproteine (Hormone: Insulin, Glucagon)
- kontraktile Proteine (Aktin, Myosin)
- Carrierproteine (Transportproteine, integrale Membranproteine
- Rezeptorproteine
- Antikörperproteine
- Speicherproteine
Ein Vergleich: Wie viele AS-Kombinationsmöglichkeiten gibt es?
H2O Moleküle in den Weltmeeren: 1046
Teilchen im Universum (nach einer Schätzung von A. Einstein) 1076
Peptid mit 100AS → 20100 ist ungefähr 10130
Bilder von Enzymen
a) Die Phenylalanin-Hydroxylase
Ist beim Abbau des Stoffes Phenylalanin beteiligt - fehlt es, liegt eine schwere (erblich bedingte) Stoffwechselkrankheit vor. ( Phenylalaninhydroxylase)
b) Lysozym

(löst Bakterienzellwände auf)
Wirkungsweise von Enzymen
Enzyme können natürlich nicht nur Substrate spalten, sondern sie können auch 2 Substrate zusammensetzen.
Andere Darstellung
Enzymatische Katalyse mit Coenzym
Grafik fehlt zur Zeit noch
Zusatzinformationen:
Wirkung eines Katalysators
- Grundsätzlich sind mehrere Wirkmechanismen möglich
- Bildung einer Zwischenverbindung
- A + Kat → AKat
- AKat + B → AB + Kat
- Oberflächenwirkung (Pt, Pd, Ni)[6]
Wirkung beruht auf
- Schwächung von Bindungen
- räumliche Annäherung der Reaktionspartner
- räumliche Fixierung
Wichtige Aufgabe:
Erkläre mit Deinen Worten die Begriffe „Enzym-Substrat-Komplex“. Verwende dazu die Begriffe „aktives Zentrum“ und „Schlüssel-Schloss-Prinzip“.
Zusatzinformationen
Verwendung von Enzymen: Kartoffel, Trockenhefe und Colorwaschmittel. Im Colorwaschmittel wirken ebenfalls Enzyme, die Flecken bei niedrigen Waschtemperaturen entfernen sollen, ohne die Farbstoffe anzugreifen.
Wieviel Aminosäuren sind in der Nahrung?
Wie Du jetzt schon weißt, sind alle Körpereiweiße aus Aminosäuren aufgebaut. Eiweiße findest Du im Körper überall. Sie sind in Form der Enzyme Bestandteil jeder Zelle, in Muskelfasern, als Hormone sowie in Gehirnzellen zur Informationsspeicherung zu finden.
Bei Menschen sind 20 verschiedene Aminosäuren[7] zu finden(proteinogene Aminosäuren). Natürlich gibt es wesentlich mehr davon in der Natur, aber diese haben bei uns keine biologische Funktion.
Von diesen 20 proteinogenen Aminosäuren kann der Mensch einige selbst herstellen, andere müssen mit der Nahrung aufgenommen werden und werden deshalb als essentielle Aminosäuren bezeichnet: Leucin, Isoleucin, Methionin, Threonin, Valin, Lysin, Phenylalanin, sowie Tryptophan müssen so mit der Nahrung aufgenommen werden. Bei Neugeborenen sind zusätzlich Histidin und Arginin essentiell.
| Aminosäure | Gramm AS/ Tag |
|---|---|
| Leucin | 1,1 |
| Isoleucin | 0,7 |
| Methyonin | 1,1 |
| Threonin | 0,5 |
| Valin | 0,8 |
| Lysin | 0,8 |
| Phenylalanin | 1,1 |
| Tryptophan | 0,25 |
Aminosäurereiche Nahrung ist besonders Fleisch und Fisch. Da natürlich auch Tiere Eiweiße verwenden. Besonders Muskelfleisch ist eine gute Aminosäurequelle.
Gleiches gilt für Eier und Milchprodukte. In Pflanzen kommen natürlich auch Eiweiße vor, aber insgesamt nicht in jeder Pflanze soviel wie im Vergleich zu den Tieren. Besonders Eiweißreiche Pflanzen sind Hülsenfrüchte, Soja sowie viele Getreide.
Im Körper werden die Eiweiße von der Magensäure und beispielsweise dem Enzym Pepsin im Magen in Aminosäuren aufgespalten. Diese gelangen dann in den Darm und durch die Darmwand ins Blut. Vom Blut kommen sie zu den Zielzellen und werden entsprechend in einem biochemischen Prozess (der Proteinbiosynthese) wieder zu (benötigten) Eiweißen zusammengesetzt.
Bodybuilder aufgepasst:
„Viel hilft viel“ gilt hier nicht unbedingt. Eine Überversorgung mit Eiweißprodukten führt erst zu Flüssigkeitsmangel, Magen- und Darmbeschwerden. Langfristig sogar zu Leber- und Nierenschädigungen.
Eine gesunde, ausgeglichene Ernährung ist mehr Wert, als täglich Eiweißpulver in sich hineinzuschaufeln! Im Übrigen schmeckt es so auch besser ;-)
Zusatzinformationen:
Hemmung von Enzymen
a) Denaturierung
Hierbei handelt es sich eigentlich nicht um eine Hemmung, sondern vielmehr um eine Zerstörung des Enzyms. Eigentlich gilt für Enzyme die RGT Regel, das heißt eine Temperaturerhöhung um 10°C beschleunigt verdoppelt die Umsetzungsgeschwindigkeit. Also je wärmer es ist, desto besser für die Umsetzung. Allerdings liegt bei ca. 43°C eine Grenze. Sulfid- und Wasserstoffbrücken lösen sich und die Tertiär- sowie die Sekundärstruktur gehen verloren. Das Enzym wird zerstört. Die Reihenfolge der Aminosäuren bleibt allerdings erhalten. Denaturierung kann ebenfalls durch Säure oder Schwermetalle ausgelöst werden.
Beispiele, wo Denaturierung eine Rolle spielt:
Bakterien sind ebenso auf Enzyme für ihre Lebensvorgänge angewiesen, wie Menschen. Im Falle einer schädlichen Infektion, reagiert das menschliche Immunsystem mit Fieber, welches die Enzyme der Bakterien denaturieren soll. Die geniale Idee dahinter ist, das lebenswichtige menschliche Organe einige wenige Zentigrad kühler (durch Kühlmechanismen wie Schweiß) sind und somit nicht so stark geschädigt werden, wie die Bakterien, welche über keinerlei Schutzvorrichtungen verfügen.
Die Informationsspeicherung im Gehirn findet über enzymatische Reaktionen statt, welche andere Eiweiße verändern. Bei Fieber funktioniert dies nicht mehr, da es zu heiß ist. Die Folge sind Fieberträume und bei hohem Fieber völliger Verlust aller kognitiver Fähigkeiten (Filmriss).
Zusatzinformationen:
b) Kompetitive Hemmung
Die Funktionsweise kann man sich von dem englischen Wort „competition“ (also Wettbewerb) ableiten. Es gibt einen Hemmstoff (=Effektor), der dem eigentlichen Substrat chemisch und v.a. strukturell ähnlich ist. Er lagert sich an das aktive Zentrum des Enzyms an und blockiert dieses, so dass das eigentliche Substrat nicht gespalten werden kann, da es gehindert wird anzudocken.
Es kommt also zum Konkurrenzkampf um das aktive Zentrum zwischen Substrat und Effektor.
Der Hemmstoff kann jedoch durch Erhöhung der Substratkonzentration wieder verdrängt werden. Die kompetitive Hemmung ist reversibel.
c) Nicht-kompetitive Hemmung
Sie funktioniert im Grunde wie die kompetitive, allerdings wird das aktive Zentrum dauerhaft blockiert. Ursache ist eine extrem hohe Affinität des Hemmstoffes an das aktive Zentrum.
Das Enzym ist dauerhaft geschädigt. Besonders Schwermetallionen wie Pb2+ lösen dies aus.
d) Allosterische Hemmung
Zusammenfassung: Das Enzym wird durch einen Hemmstoff in seiner Form verändert. Dieser greift zwar außerhalb des aktiven Zentrum an, verändert jedoch dessen Form, so dass kein Substrat mehr umgesetzt werden kann.
Wird das erste Enzym einer Reaktionskette durch eines der am Ende gebildeten Produkte gehemmt, spricht man auch von Feedbackhemmung.
Beispiel: Allosterische Hemmung einer Synthese einer benötigen Aminosäure bei E-Coli
Innerhalb einer Zelle wird logischerweise nicht permanent die DNA in RNA übersetzt und es werden nicht kontinuierlich alle möglichen Proteine gebildet. Vielmehr muss es sehr sensible und ausgefeilte Mechanismen geben, die die Aktivität der produzierenden Enzyme regelt.
Das Darmbakterium E-Coli kann alle benötigten Bausteine der DNA sowie alle Aminosäuren selbst herstellen. Diese Synthesen Verlaufen oft über Zwischenprodukte. Die notwendigen Zwischenschritte sind natürlich ebenfalls enzymkatalysiert.
Zur Erinnerung: Enzyme liegen im Normalfall nach ihrer Reaktion unverändert vor und können weitere Katalysen durchführen:
Das entstandene Produkt kann nun Einfluss auf das Enzym 1 haben. Bei dieser Art der Hemmung, hat das Enzym einen Bindungsport, welcher an das Produkt andockt. Dadurch verändert sich aber die Form des aktiven Zentrums - man könnte sich Vorstellen, das Enzym wird etwas „zusammengepresst“. Das nun veränderte aktive Zentrum, kann erstmal solange keine weiteren Katalysen durchführen, wie das Produkt nicht anderweitig vom Organismus benötigt und somit entfernt wird.
Eine solche Hemmung, wo das Endprodukt die Aktivität des ersten Enzyms einer Synthesekette hemmt, bezeichnet man als direkte Endprodukthemmung. Da das Enzym in seiner Form (reversibel) verändert wird, spricht man auch von allosterischer Hemmung. Enzyme, welche einen dafür notwendigen Bindungsport haben sind allosterische Enzyme (stereo =Raum, allos = anders). Solche Enzyme sind immer aus mehreren Polypeptidketten aufgebaut, welche zum Produkt passt. Da das Produkt stärker hemmt, je mehr von ihm vorhanden ist, ist die allosterische Hemmung Konzentrationsabhängig. Das Produkt ist demzufolge ein Inhibitor.
Zusatzinformationen: Oft liegt an allosterischen Enzymen noch ein dritter Bindungsport vor, über den die Enzymaktivität gesteigert werden kann. Allosterische Enzyme können unter Umständen sogar gleichzeitig gehemmt und gefördert werden. so kommt im Organismus eine sehr feine Regelung zustande.
Schöne Animationen zur Enzymwirkung und -hemmung:
Einfluss des pH-Wertes auf die Enzymwirkung
Jedes Enzym hat ein bestimmtes pH-Wert-Optimum. Dieses muss nicht notwendigerweise im neutralen (pH = 7) liegen. In diesem Optimumsbereich läuft die Umsetzung am besten ab. Liegt der pH-Wert weit außerhalb des Optimums, findet eine (zuerst reversible) Inaktivierung oder gar eine Denaturierung statt.
Vergleicht man verschiedene Verdauungsenzyme, so sieht man, dass sie vom pH-Wert an ihr Milieu angepasst sind. (Pepsin an das Milieu des sauren Magens, Amylase an das meist neutrale Milieu im Mund, Trypsin an das alkalische Darmmilieu.)
Das pH-Optimum der Stärke-spaltenden Amylase im Mund liegt bei pH 7-7,5.
Pepsin im Magen spaltet Eiweiße bei ca. pH 2. Trypsin zersetzt Eiweiße hingegen bei pH 8 im Darm.
Weitere Enzyme mit unterschiedlichen pH-Optima:
- Arginase zersetzt im Harnstoffzyklus Arginin in Harnstoff und Ornithin bei ca. pH 10.
- Ungefähr zwischen pH 7 und 9 liegt das pH-Optimum der Pankreas-Lipase im Dünndarm von Säugetieren
Zusatzinformationen
Ein Beispiel für Eiweiße im Alltag - die Dauerwelle
Möchte man als Mensch mit glatten Haaren Locken haben, so ist eine Dauerwelle die perfekte Lösung. Die Haare werden durch eine biochemische Reaktion irreversibel gewellt. Erst wenn die Haare nachwachsen, muss die Dauerwelle erneuert werden.
Der deutsche Friseur Karl Nessler hat 1906 die Dauerwelle erfunden. Dabei wird durch das Reduktionsmittel Ammoniumthioglykolat die Tertiärstruktur des Keratins der Haare, welche besonders viel des Proteins Keratin enthalten, verändert. Disulfidbrücken, welche als Atombindungen die Schwefelatome zweier Cystein-Aminosäuren in der unbehandelten Keratin-Tertiärstruktur "zusammenklammern", werden durch Reduktion geöffnet. Die Proteinstruktur des Keratins der Haare ist nun entnetzt und verformbar. Die Haare dann kommen auf einen Lockenwickler und die Disulfidbrücken werden anschließend wieder, diesmal zwischen anderen Cysteinresten von Keratin, durch Oxidation mit Wasserstoffperoxid ausgebildet. Das Haar nimmt dabei die Form der Matrize, nämlich des Lockenwicklers, an. Hut ab ;-)
Bei der so genannten Gegenwelle wird das Gegenteil bewirkt. Gelockte Haare werden vor dem Oxidationsprozess geglättet.
- Zusatzinformationen
Was haben Spaghetti und Dauerwellen gemeinsam: http://www.die-maus.de/sachgeschichten/dauerwellen/
Wiederholungsfragen
- Aminosäuren werden auch Zwittermoleküle genannt. Erkläre dies mit ihrem Aufbau und den entsprechenden Säure-Base Definitionen.
- Was versteht man unter Aminen bzw. Carbonsäuren?
- Wieviel verschiedene Aminosäuren gibt es und welche sind für den Menschen wichtig?
- GK/LK: Erkläre am Beispiel einer einfachen Aminosäure die Besonderheit des Zwitterions. Welcher Zusammenhang besteht zum IEP?
- Was versteht man unter einer Peptidbindung? Was unter einem Dipeptid (bzw. Polypeptid)?
- Versuche mithilfe einer Skizze die Begriffe Primär-, Sekundär-, Tertiär- sowie Quartärstruktur zu erklären.
- Was versteht man unter endo- bzw. exothermen Reaktionen? Erkläre jeweils an einem (beschrifteten) Energiediagramm
- Was ist ein Katalysator? Was bewirkt er aus chemischer Sicht?
- Warum werden Enzyme auch Biokatalysatoren genannt?
- Wie wehren sich Zellen gegen das in ihnen entstehende Gift Wasserstoffperoxid (H2O2)?
- Welche Typen von Proteinen gibt es? Kann man also sagen, dass "alle Enzyme Proteine und alle Proteine Enzyme sind"?
- Zu Wasserstoffperoxid wird etwas Leber zugegeben. Nenne Beobachtungen und erkläre das Ergebnis
- Dieser Versuch funktioniert auch ohne Enzyme, indem man Wasserstoffperoxid einfach lange mit dem Brenner erhitzt. Zeichne ein Energiediagramm für die Reaktion mit dem Brenner und eines für die enzymatisch katalysierte Reaktion.
- Was passiert eigentlich, wenn die oben genannte Reaktion zum Erliegen kommt und man erneut H2O2 zufügt? Geht die Reaktion weiter? Begründe
- Die Wirkung von Enzymen ist von mehreren Faktoren abhängig. Nenne sie und erkläre ihren Einfluss
- Beim längeren Kauen von Schwarzbrot entsteht nach einiger zeit ein Süßer Geschmack auf der Zunge. Erkläre! (Tipp: In Schwarzbrot ist Stärke enthalten, welche ja bekanntlich aus ... aufgebaut ist)
- Gebe mit Hilfe von Zeichnungen die Wirkungsweise eines spaltenden Enzyms wieder.
- Finde Beispiele für Enzyme, welche eine gegenteilige Reaktion durchführen
- Erkläre die folgende Grafik zu den Enzymen Amylase (spaltet Stärke), Pepsin und Trypsin (spalten beide Eiweiße)
- Was versteht man unter Hemmung? Welche Arten gibt es. Erkläre auch mit Hilfe von Zeichnungen
- Was sind Coenzyme? Was sind Effektoren?
- Welche weiteren Faktoren haben Einfluss auf die Enzymwirkung?
- ↑ z.B. bei Atmung/ Gärung
- ↑ Das dazugehörige Gesetz ist die RGT-Regel
- ↑ Alle natürlichen AS haben L-Konfiguration
- ↑ Isoelektrischer Punkt: Isoelektrischer Punkt
- ↑ kovalent = durch Atombindung → es liegt eine Atombindung zwischen zwei Schwefelatomen vor!
- ↑ siehe Döbereiners Platinfeuerzeug
- ↑ Neuere Modelle zählen Selenocystein auch dazu, da es bei vielen Bakterien zu finden ist - so dass man oft auch von 21 proteinogenen Aminosäuren spricht
Kunststoffe
Was sind Kunststoffe?
Betrachte einmal verschiedene Kunststoffarten. Obwohl wir alle Kunststoffe mit den Oberbegriffen Kunststoff und Plastik beschreiben, gibt es doch offensichtlich große Unterschiede.
Wofür werden Kunststoffe benötigt? Wo tauchen sie in unserem Leben auf?
- Brainstorming
- Verpackungsmaterial
- Textilfasern
- Wärmeisolierung
- Rohre
- Bodenbeläge
- Lacke
- Klebstoffe
- Kosmetika
- Kabel
- Gebäude
- Reifen
- Kunststoffe dienen z.B.
- als Verpackungsmaterial
- als Textilfasern (Kunstfasern)
- zur Wärmeisolierung
- als Ausgangsstoff für Rohre
- als Bodenbeläge
- als Lack- und Farbenbestandteile
- als Klebstoff
- als Inhaltsstoffe in Kosmetika
- als Isolierungsmaterial
- für Reifen
- als Polster
- für Autoarmaturen
- Kanister und Tanks
- usw...
Zusatzinformationen Kunststoff Polymerchemie
Untersuchung von Kunststoffen
- Material
- Polyamid (PA)
- Kupferdraht
- Polyethylen (PE)
- Polystyrol (PS)
- Plexiglas (PMMA)
V1: Schmelzen und Verbrennen von Kunststoffen
Der Bunsenbrenner wird mit einem Winkel von 45° eingespannt, Alufolie unter gelegt und dann die folgenden Substanzen in und außerhalb der Flamme untersucht.
Besonderes Augenmerk ist dabei auf Entzündbarkeit sowie die selbstständige Brennbarkeit zu legen. Auch die viskosen Eigenschaften der geschmolzenen Kunststoffe sollen notiert werden. In die Dämpfe kann etwas feuchtes Indikatorpapier gehalten werden.
ACHTUNG: Die Verbrennung von PVC und auch die Beilstein-Probe (s. u. V3) erzeugen Dioxine und Furane. Sie sind daher in einigen Bundesländern bereits verboten und sollten nicht mehr durchgeführt werden!
V2: Identifizieren eines unbekannten Kunststoffs
Durch Vergleich soll ein unbekannter Kunststoff mit den Ergebnissen der aus V1 bekannten Eigenschaften identifiziert werden.
V3: Beilsteinprobe
Ein Kupferdraht wird in der Bunsenbrennerflamme ausgeglüht und dann mit etwas PVC bzw. PE benetzt. Er wird erneut in die Flamme gehalten. (Erinnere Dich an die Beilstein-Probe auf Halogene.)
V4: Dichte
Teste die Dichte von Kunststoffen in Wasser
Zusatzinformationen Beilsteinprobe
Unterscheidung von Kunststoffen
| Versuch | Beobachtung | Schlussfolgerung |
|---|---|---|
| Schwimmverhalten: | ||
| Polyethylen | schwimmt | → < 1,0 g/cm3 |
| PVC | schwimmt nicht | → > 1,0 g/cm3 |
| Brennverhalten: | ||
| PE |
|
|
| PVC |
|
|
| Zersetzungsprodukte:
Erhitzen im RG und dabei die Zersetzungsgase mit feuchtem Indikatorpapier untersuchen |
||
| PE | keine Verfärbung | Keine Säurebildung |
| PVC | Rotfärbung | Verbrennungsgase sind sauer:
|
Aufgaben:
- Nenne Vorteile sowie Nachteile von Kunststoffen und deren Gebrauch
Allgemeines zu Kunststoffen: Was sind Kunststoffe?
Kunststoffe bestehen vor allem aus den Elementen Kohlenstoff und Wasserstoff. Auch wenn es nicht so scheint, so sind sie doch Kohlenwasserstoffe. Sie sind aus einzelnen kleinen Bestandteilen, den Monomeren, durch Verkettung der einzelnen Monomermoleküle zu sehr langen Ketten zusammengefügt (so genannten Makromolekülen bzw. Polymere). (Altgriechisch: mono = 1, makro = groß, polys = viel, meros = Teil)
Die ersten Kunststoffe waren:
- 1869 Celluloid (für Kämme, Puppen, Filme)
- 1885 (Bakelit) Kunsthorn (Knöpfe, Schnalle, Füllhalter)
Gemeinsame Eigenschaften von Kunststoffen:
Meist haben Polymere eine geringe Dichte, nur schlechte Leitfähigkeit für Wärme und Strom sowie hohe Beständigkeit gegen Säuren & Laugen und Verwitterung. D.h. Kunststoffe sind in der Regel sehr lange haltbar. Ein Becher aus Kunststoff verwittert in 10 000 Jahren nicht! Wie beseitigt man also auf ökologischem Wege Kunststoffe?
Kunststoffschäume wie z.B. Schaumstoff sind sehr gute Schall- und Wärmeisolatoren.
In der Regel sind Kunststoffe nicht temperaturbeständig. Sie schmelzen oder verkohlen bei höheren Temperaturen. Beim Verbrennen entstehen z.T. giftige Gase (Dioxine). Viele Kunststoffe sind eher wenig kratzfest, und oft brüchig (besonders, wenn sie länger dem Sonnenlicht ausgesetzt sind). Sie neigen zur elektrostatischen Aufladung (besonders Folien).
Grundsätzlicher Aufbau von Kunststoffen
Kunststoffe bestehen aus langen, ineinander verschlungener Molekülketten. Deren Anzahl kann in die Millionen gehen (→Polymere). Aufgrund der Größe der einzelnen Moleküle spricht man auch von Makromolekülen. Betrachtet man die Makromoleküle genauer, erkennt man dass es sich immer wieder um stets wiederholenden Grundeinheiten (so genannte Monomere) handelt, welche zu Ketten verbunden sind (Vergleichbar mit einer Perlenkette).
Beispiel: Polypropylen ist ein Kunststoff aus sich vielfach wiederholenden Propyleneinheiten
- Monomer = Einzelbaustein: ⎕
- Polymer = Makromoleküle bestehend aus vielen durch Atombindungen (=kovalent) verknüpften Monomeren: ⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕-⎕
Man unterscheidet dabei zwischen:
- „Homopolymer“ = nur eine Monomerensorte
- „Copolymer“(Heteropolymer) = verschiedene Monomerensorten (alternierend oder statistisch)
- Pfropfpolymere: Untergruppe der Copolymere. Merkmal: die Seitenketten der Polymerkette sind aus anderen Monomeren aufgebaut.
Eine bekannte Verwendung von Copolymeren ist der Einsatz in Bausteinen für Kinder. Sie bestehen in der Regel aus Acrylnitril, 1,3 Butadien und Styrol (ABS-Kunststoff). Sie sind leicht färbbar und durch ihre Härte nahezu unzerbrechlich. Weitere ABS-Kunststoffe findet man in Staubsaugergehäusen und im Autobau der Automobilindustrie.
SBR-Kunststoffe (aus Styrol und Butadien - das R steht für "Rubber") werden als Synthesekautschuk für Schläuche, Autoreifen usw. verwendet.
Aufgaben:
- Können Kunststoffe brennen? Begründe mit ihrem Aufbau!
- Welche Eigenschaften sprechen für den Kunststoffeinsatz im Auto (in der Küche)?
- Ordne den 3 Kunststoffgruppen Verwendungsbeispiele zu!
Einteilung der Kunststoffe
Es gibt mehrere Möglichkeiten Kunststoffe einzuteilen. Nach der Zusammensetzung bzw. nach den Eigenschaften.
Einteilung von Kunststoffen nach den Eigenschaften:
- Thermoplaste (= Plastomere) sind durch Hitze verformbar
- Duroplaste (= Duromere) sind hart
- Elastomere (= Elastoplaste) sind elastisch und gummiartig
a) Thermoplaste

Sie gehören in die Gruppe der “Plaste” (wie die Duroplaste).
Die Polymere der Thermoplaste sind meist lang und linear, also wenig verzweigt. Die Moleküle liegen entweder als Knäul oder parallel angeordnet (wie Streichhölzer in einer Packung) vor. Ein Polymermolekül kann dabei 10-6 - 10-3 mm lang und 104 - 106 u schwer sein.
Die namensgebende Besonderheit der Thermoplaste ist, das sie bei Hitze verformt werden können. Da die Polymerketten allerdings nicht alle identisch sind, hat man unterschiedliche Atomgewichte und somit verschiedene Wechselwirkungen der Atome untereinander (im Grunde liegt ein Gemisch vor). Als Konsequenz haben die Polymerketten unterschiedliche Schmelz- und Siedepunkte, so dass der ganze Kunststoff eher Schmelz- und Siedebereiche, anstelle von exakten Schmelz- und Siedepunkten hat. Sind die Temperaturen nicht zu hoch, werden die Polymere übrigens beim Schmelzen nicht verändert, d.h. nach dem Abkühlen liegt wieder der gleiche Kunststoff vor, nur in einer anderen Form. Thermoplaste sind recht schwer entzündbar. Sie sind geruchs- und geschmacksneutral.
Bekannte Vertreter der Thermoplaste sind: Polyethylen, Polyvinylchlorid, Polystyrol, Polyamid
b) Duroplaste

Die Polymere der Duroplaste sind untereinander dreidimensional engmaschig vernetzt. Dadurch haben sie eine hohe Härte und Festigkeit[1] („Duro“ = hart). (D Makromolekülen, die untereinander durch Atombindungen vereinigt sind! Es liegt pro Kunststoff nur ein einziges (!) Molekül vor.
Duroplastische Kunststoffe werden auch bei hohen Temperaturen nicht weich. Sie schmelzen auch bei Hitze nicht, da die dreidimensionale Vernetzung erhalten bleibt. Sie bleiben so lange harte & spröde bis sie verkohlen.
Duroplaste sind schwer entflammbar, hart und kaum Verformbar, geruchs- und geschmacksneutral.
Bekannte Vertreter der Duroplaste sind „Phenoplast“ und „Aminoplast“.
- Phenoplast
- hart, durch Füllstoffe (Holzmehl u.a.) spröde und zäh
- meist in dunklen Farben
- für Elektroartikel (Stecker usw.), Dosen
- früher als Kraftfahrzeugkarosserie (Trabant)
- Aminoplast
- hart, meist schlagfest, farblos oder gefärbt
- für Geschirr, Spielwaren, Wärme- und Schallisolation
c) Elastomere
Elastomere sind elastisch wie Gummi. Man kann sie auseinanderziehen oder auch zusammendrücken. Sie nehmen schnell wieder ihre ursprüngliche Form an. Man spricht auch vom „Gedächtnis“ des Kunststoffes. Wenn Du Dir jetzt einen Softball oder einen Schwamm vorstellst, siehst Du einen Elastomer.
Die Polymerketten der Elsastomere sind zwar untereinander vernetzt und vor allem verknäult, aber nicht so stark wie bei den Duroplasten. Vielmehr liegt eine weitmaschige Vernetzung vor, wodurch die gummielastisch werden. Zieht man an Elastomeren, so werden die Polymerknäule auseinandergezogen, wobei die Makromoleküle aneinandergleiten. Sowie der Zug aufhört, verknäulen sich die Moleküle wieder zu ihrer ursprünglichen Form. Genau wie die Duroplaste sind sie nicht schmelzbar. Sie sind aber im Vergleich leichter zu entzünden.
Elastomere können aus Rohkautschuk hergestellt werden. Dazu muss der Rohkautschuk durch eine Reaktion (Vulkanisation, bei der sich Schwefelbrücken ausbilden) bearbeitet werden. Wird keine Vulkanisation durchgeführt, bleiben die Polymere brüchig.
- Vertreter
- (alles Gummi- und gummiähnliche Stoffe)
- Polyurethan
- Polyester (Kunstfasern → für Textilien geeignet)
- Polyurethan
- den Polyamiden ähnlich
- meist schaumstoffartig
- Grundstoff für viele Klebstoffe
- Grundstoff für einige Textilifasern
Zusatzinformationen:
Aufgaben
- Eine Bleistiftlinie soll Polymerkohlenstoffkette darstellen. Wie würdest Du dann den Aufbau der Thermoplaste mit Linien zu zeichnen?
- Wie würdest Du nun einen Duroplasten zeichnen? Bedenke dabei die Art der Verknüpfungen. Wo werden Duroplaste verwendet?
- Wie würdest Du den Aufbau von Elastomeren skizzieren? Wo werden sie verwendet?
- Gerade bei Elastomeren spricht man vom Gedächtnis der Kunststoffe. Begründe warum, anhand eines Softballs.
- Welches Atomgewicht hat ein Moleküls, welches 1500mal aus Ethen besteht. Wie heißt es?
- Wo finden thermisch verformbare Kunststoffe ihre Anwendung? Bedenke auch deren Herstellungsprozess.
- Bei Thermoplaste liegt kein einheitlicher Schmelzpunkt vor? Warum nicht?
- Welchen Vorteil hat eine gute Hitzebeständigkeit (vor allem bei Duroplasten) (Tipp: Geschirr).
Gummi - ein natürlicher Elastomer
Die Milch des Gummibaums ist ein natürliches Gemisch (mit ca. 40% Kautschuk) und wird beim Aushärten mit Sauerstoff zum natürlichen Kunststoff Latex. Mit Hilfe von Säure wird die Milch zu Rohkautschuk verarbeitet und bei Bedarf gleich, oder später mit Schwefel erhitzt (=vulkanisiert). Dabei binden sich Schwefelatome mit dem Rohkautschuk. Das entstehende Produkt ist Gummi.
Der Anteil des Schwefels bestimmt dabei die Weichheit:
- < 2% Schwefel → Weichgummi
- 2%-30% → Gummi
- > 30% Schwefel → Hartgummi (z.B. für Autoreifen).

Zusatzinformationen
Einteilung von Kunststoffen nach der Herkunft der Ausgangsstoffe:
Zur Geschichte der Kunststoffe
Erste Kunststoffe: Zellulosenitrat (auch Nitrocellulose bzw. Celluloid genannt)

Herstellung durch Nitrieren von Cellulose
Zusatzinformationen
Erste Kunststoffe: Bakelit (Phenol-Formaldehyd-Kunstharz)
Herstellung
Struktur
Zusatzinformationen
Ausgangsstoffe der Polymerisation und die daraus gebildeten Kunststoffe
Bei der Synthese von Kunststoffen werden viele kleine Monomere zu ketten- oder netzförmigen Polymeren verkettet. Tausende von Molekülen des Ausgangsstoffes werden dabei zu einer Kette zusammengesetzt.
Kunststoffgewinnung (I) aus Naturstoffen
a) Regenerierte bzw. umgewandelte Naturstoffe (makromolekular)
(1) halbsynthetische Zellulusefasern
Baumwolle: 90% lange Zellulosefasern
aber: Rohstoffbedarf der Textilindustrie hoch → Verwendung auch kurzkettiger Zellulose
Ausgangsstoff: kurzkettige Zellulose aus Holz
Endstoff: Reyon („Kunstseide“), langfaserig, spinnbar(bzw. Cellophan (flexibler durch Glycerin)
z.B. Viskoseverfahren
Cellulose + 20%ige NaOH + CS2 → zähflüssige Viskose
Säurebad: langkettige Zellulose
Formeln nur für LK:
- Bildung eines Xanthogenats
- regenerierte Cellulose (=spinnbares Reyon)
(2) Vulkanisierter Gummi - Naturkautschuk (zuerst von Goodyear 1839)
Ausgangsstoff: Naturkautschuk (natürliches Polymer aus Isopren)
(Südamerika: Kautschukbaum – Hevea brasiliensis → Latex = Milchsaft ( Kautschukemulsion)
Kunststoffsynthese (II) durch Polymerisation

Die Polymerisation (der Monomere) kann durch Radikale ausgelöst werden. Dabei bindet ein Radikal an ein ungesättigtes Molekül (z.B. Styrol). Dieses wird selbst zum Radikal und bindet an ein weiteres Molekül, usw...
Bei der eigentlichen Reaktion lagern sich immer ungesättigte Monomere (meist Alkene) unter Öffnung der Doppelbindung zusammen. Das Produkt wird dann entsprechend seiner Monomere benannt (Ethen reagiert zu Polyethen).
Ein so entstandener Polymer besteht aus Tausenden von Monomeren. Man nennt solche Moleküle auch Makromoleküle. Da alle gebildeten Polymerketten eine verschiedene Länge haben, sind die Moleküle eines Kunststoffes also nicht nicht alle gleich groß. Die Folge sind uneinheitliche Molekülmassen und somit keine exakten Schmelz- und Siedepunkte (sondern eher Schmelz- und Siedebereiche).
(Vergleich des Prinzips der freien Hand mit Tanzpaaren paarweise → Aufbruch zur Kette durch einen einzelnen Tänzer )
Radikalische Polymerisation I: Bildung von Polyethylen
Radikalische Polymerisation II: Bildung von Polystyrol (Styropor) aus Styrol
Polystyrol (PS bzw. Polystyren) ist ein meist transparenter Thermoplast mit großer Verbreitung. Er wird als Schaumstoff bzw. Verpackungsstoff verwendet. Er ist gegen Säuren und Laugen unempfindlich, gegenüber apolaren Lösungsmitteln wie z.B. Benzin nicht.
Styropor als Isolierungsmaterial
Abbruchreaktionen: Der Abbruch der radikalischen Kettenreaktion kann durch Vereinigung zweier Radikale (Rekombination) oder durch Bildung von Alkan und Alken durch Übergang eines Wasserstoffatoms erfolgen.
Zusatzinformationen Polystyrol (siehe auch Beständigkeit) Schaumstoff
Kationische und anionische Polymerisation
Neben der Radikalischen Polymerisation ist auch eine Polymerisation durch starke Ionen möglich. Als Kation kann dabei als Startion H+ dienen, also starkes Anion (C4H9)-.
Die Ionen (je nach Mechanismus als Kation oder als Anion - niemals liegen beide vor!) greifen nun jeweils die Mehrfachbindung an, um so die Kettenreaktion zu starten.
Der Kettenabbruch erfolgt entweder durch Zusammentreffen von
a) Kation und einem in der Reaktion entstandenem Anion.
b) Anion und einem in der Reaktion entstandenem Kation.
Zusatzinformation: Polymerisation#Kationische und Anionische Polymerisation
Technisch wichtige Polymere
| Monomer | Abkürzung | Polymer |
|---|---|---|
| Ethen | PE | Polyethen |
| Propen | PP | Polypropen |
| Styrol | PS | Polystyrol (Styropor) |
| Vinylchlorid | PVC | Polyvinylchlorid |
| Methacrylsäureester | PMMA | Polymethacrylsäureester(=Plexiglas, Acrylglas) |
| Tetrafluorethen | PTFE | Polytetrafluorethen |
Kunststoffsynthese (III) durch Polykondensation
Erinnere Dich: Bei der Esterbildung reagieren immer eine Säure und ein Alkohol miteinander. Dabei spaltet sich Wasser ab (=Kondensation).
Da es allerdings auch Mehrfachalkohole (z.B. Glycerin) bzw. Dicarbonsäuren gibt, kann man sozusagen, die Veresterung an beiden Enden der Moleküle durchführen. Es kommt dabei zur Kettenbildung unter vielfacher Wasserabspaltung (=Polykondensation).
Die Reaktion kann anstelle von Diolen auch mit Diaminen durchgeführt werden.
Zwei Typen der Polykondensation im Vergleich
Polyester
Polyester sind Polykondensate. Sie sind Kunststoffe, welche durch eine Verersterung von
Ethandiol (oder anderer mehrwertiger Alkohole) mit kurzkettigen Dicarbonsäure (z.B. Ethandisäure) in entstehen. Da es sich um eine Verersterung handelt, tritt dabei Wasser aus.
Polyester sind im Gegensatz zu den Ausgangsstoffen hydrophob, da die hydrophilen Gruppen -COOH sowie -OH sich bei der Veresterung verbinden und so ein Großteil des Dipolcharakters verloren geht. Durch diese Wasser abweisende Eigenschaft, trocknen Polyester (z.B. als Kunstfaser in Kleidung) besonders schnell. Der Nachteil ist, dass Polyester allerdings auch keine Körperfeuchtigkeit aufnehmen. In reiner Polyesterkleidung schwitzt man also stärker. Das Tragen ist deshalb auch nicht so angenehm. Die Lösung sind Mischgewebe in denen Polyester mit z.B. Baumwolle vermischt sind. Solche Kleidungsstücke sind in der Regel hautfreundlich, trockenen schneller (obwohl sie auch Schweiß aufnehmen). Außerdem sind sie nach dem Waschen meist knitterfreier.
Zusatzinformation:
Bekannte Polykondensationsprodukte: Die Polyamide - Nylon und Perlon
V: Nylonherstellung
Material: Schutzbrille, Handschuhe, 2 Bechergläser (200 sowie 50/100ml), Glasstab.
Ca. 0,55 g 1,6-Diaminohexan werden in ein Becherglas zu 45 mL Wasser und 2 NaOH-Plätzchen gelöst. Zum Auflösen mit einem Glasstab 2 min. rühren. Einen Tropfen Phenolphtalein zufügen (erhöht die Sichtbarkeit!)
In einem zweiten (100 mL bzw. 50 mL) Becherglas werden vorsichtig mit dem Gemisch aus 1 mL Sebacinsäuredichlorid (bzw. Hexandicarbonsäure-dichlorid) und 15 mL Heptan vermischt. Dieses zweite Gemisch kommt über das erste (Überschichtung). Zum Überschichten kann ein Glastrichter verwendet werden. Nun wartet man ca. 3 min.
Das Produkt entsteht nun an der Phasengrenze als "Haut" und kann mit einer Pinzette herausgezogen und anschließend um einen Holzstab oder ein Reagenzglas gewickelt werden.
Wenn man keine Lust mehr zum Drehen hat, kann man das Gemisch auch mit dem Holzstab umrühren, so dass die Reaktion wesentlich schneller abläuft. Es entsteht ein Klumpen. Die Entfärbung des Phenolphtaleins zeigt das Ende der Reaktion an.
Zusatzinformationen:
- Technische Synthese von Nylon 66 aus AH-Salz: Adipinsäure + Hexamethylendiamin
- Perlon (= Nylon 6) aus H2N-(CH2)5-COOH über Caprolactam
- Kevlar: ...-CO-C6H4-NH-[-CO-C6H4-NH-]n-CO-C6H4-NH-... aus p-Aminobenzoesäure
Bekannte Polykondensationsprodukte: Polyester
V1: 1ml Glycerin und 3,5 g Bernsteinsäure (Butandisäure) werden bei kleiner Flamme vorsichtig in einem Reagenzglas (fast waagerecht halten und leicht schwenken!) erhitzt.
Zum Überprüfen weiterer Produkte wird dabei ein angefeuchtetes Indikatorpapier an die Öffnung des RG gehalten. Die ursprünglich dünnflüssige Masse wird nach einiger Zeit dickflüssig. Beim Abkühlen wird sie fest.
Man kann auch anstelle der Bernsteinsäure auch andere Dicarbonsäuren verwenden:
Polyester aus Benzol-1.2-dicarbonsäure (=Phthalsäure)
3 g Phthalsäureanhydrid und z.B. 3 mL Propantriol in ein RG geben, 20 min über kleiner Flamme erhitzen → Glyptal, Lackrohstoff
Polyester aus Glycerin und Citronensäure
1,9 g Citronensäure (bzw. 2,1 g Citronensäuremonohydrat) und 6 Tropfen Glycerin werden vermischt und entsprechend den vorherigen Versuchen 2 min. erwärmt.
Es entsteht ein linearer Polyester (lineare Polyester bilden Thermoplaste)
Zusatzinformationen:
- Polyethylenterephthalat (PET)
Windelversuch
Babywindeln müssen sehr viel Flüssigkeit aufnehmen. Normale Watte kann ca. 50% ihres Eigengewichtes an Wasser tragen, danach tropft es heraus. Auch durch Druck, z.B. durch Sitzen auf der Watte, kann Flüssigkeit austreten.
Aus diesem Grunde ist heute ein wichtiger Bestandteil von vielen Windel ein „Superabsorber“ aus vernetzten Polyacrylfasern. Die schwach durch Butan-1,4-diol vernetzten Polyacrylsäuren quellen bei Kontakt mit Wasser zu einem Gel auf. In diesem Zustand befinden sich zwischen den Fasern große Lücken, in die die Wassermoleküle eingelagert werden. Selbst unter Druck bleibt das Wasser so chemisch gebunden. 1g Gel kann dabei bis zur 20-30fachen Menge seines Eigengewichtes fest binden.
Tipps für die Versuche:
- Gewogen wird in Bechergläsern, so dass kein Wasser in die Waage fließt!
- Kein Superabsorber einatmen, in die Augen oder in das Waschbecken!
V1: Eine Windeleinlage wird von den Klebebändern befreit und in ca. 4 Längstreifen geschnitten. Diese wird gewogen und dann in Wasser getaucht und erneut gewogen. Zum Vergleich wird der Versuch mit einem gleichschweren Papiertaschentuch wiederholt. Ein Auspressen beider Streifen kann abschließend versucht werden.
V2: Ein Streifen einer Windel wird über einem Blatt Papier zwischen den Fingern zerrieben und dann das gewonnene Pulver durch ein Teesieb von den überflüssigen Zellstofffasern befreit.
Die so gereinigten Superabsorberkörner werden in ein Reagenzglas gefüllt und mit einem Folienstift der Stand markiert. Nun wird solange Wasser zugefügt, wie es vom Absorber gehalten wird.
Hilfen zur Auswertung der Versuche:
Propensäure (=Acrylsäure) ist eine mittelstarke Carbonsäure mit stechend riechendem Geruch. Reagiert sie mit einem Radikal (Startersubstanz z.B. ein Peroxid vom Typ: R-O-O-R‘), bildet sich Polyacrylsäure.
1. Nach welchem Reaktionsmechanismus reagieren beide Stoffe zu Polyacrylsäure? Formuliere den Mechanismus inklusive des Kettenabbruchs.
Tipp: notiere die Acrylsäure in der folgenden Form: 
2. Gibt man zu Polyacrylsäure (=Polypropensäure) nun Butan-1,4-diol hinzu, so werden die Polyacrylsäurefasern untereinander vernetzt, so dass eine Netzstruktur entsteht. Bei diesem Vorgang wird Wasser frei. Je mehr Butan-1,4-diol dabei reagiert, desto stärker ist logischerweise die Vernetzung.
a) Stelle den Mechanismus zur Bildung des vernetzen Superabsorbers auf (Formelausschnitte reichen!). Wie nennt man diese Reaktion?
b) Wie kann man sich und die Wasseraufnahmefähigkeit des Superabsorbers erklären?
c) Inwiefern hat der Vernetzungsgrad Einfluss auf die Wasserabsorbtionsfähigkeit des Produktes?
Kunststoffsynthese (IV) durch Polyaddition
Die Polyaddition ist wie die Polymerisation eine ständig fortlaufenden Reaktion. Allerdings kommen keine Radikale zum Einsatz. Als Ausgangsstoffe (Edukte) werden mindestens zwei verschiedene Moleküle verwendet (so genannte bifunktionelle Moleküle). Es entstehen keine Nebenprodukte (wie z.B. das Wasser bei der (Polykondensation).
Das wichtigste Kennzeichen ist dabei der Übergang von Wasserstoffatomen von einem Monomer zum anderen.
Durch Polyaddition werden z.B. Polyurethane hergestellt. Diese finden als Schaumstoffe in Verpackungsstoffen, Schuhsohlen sowie Matratzen und Kissen wieder. Das Aufschäumen kommt dabei durch den Einschluss von Kohlenstoffdioxid, welches sich bei der Reaktion eines Ausgangsstoffes mit Wasser bildet.
So können sie auch in Hauswände zur Wärmeisolierung gespritzt werden - die Zugabe von Wasser startet dann den Schaumvorgang.
Beispiel: Bildung von Polyurethan
Polyurethan entsteht durch eine Polyaddition eines Diisocyanats (Cyanat: N=C=O-H, bzw. N≡C-O-H) mit einem Diol (Zweifachalkohol). Das Kohlenstoffatom ist durch die elektronenziehende Wirkung des Stickstoffes positiviert, so dass es Elektronen vom Sauerstoff des Alkohols an sich zieht, so dass die OH-Gruppe schließlich ihr Proton an den Stickstoff abgibt.

Es bildet sich ein Polymer. Aber, wie kommt es zum Aufschäumen? In einer Nebenreaktion entsteht Kohlenstoffdioxid durch die Reaktion von Diisocyanat mit Wasser. Das entstehende Kohlenstoffdioxid lässt den Kunststoff aufquellen:
O=C=N–R1–N=C=O + H2O –→ H2N–R1–N=C=O + CO2 ↑
Versuch: Herstellung eines Polyurethanhartschaums
Im Abzug arbeiten, Schutzbrille und Schutzhandschuhe benutzen!
In einen Plastikbecher (z.B. Getränkebecher oder Joghurtbecher wird der Boden gut mit Desmophen® (Polyol) und dem Aktivator bedeckt. Dann wird ungefähr die gleiche Menge Desmodur® (Isoycanat) sowie zwei Spritzer Wasser hinzugefügt.
Mit einem Holz- oder Glasstab wird gerührt, bis eine Reaktion einsetzt. Das Volumen des sich bildenden Schaumstoffs ist bis zu 30mal so größer, als das der Edukte.
Zusatzinformationen
Vergleich der Polymertypen nach ihren Eigenschaften
| Duroplaste sind nicht verformbar, thermisch nicht verformbar | eng vernetzte Kohlenstoffketten | Silikonkautschuk | Polyurethane | |
| Elastomere sind elastische Kunststoffe, welche auf Zug oder Druck hin sich verformen. | weitmaschige vernetzte Kohlenstoffketten | Synthetischer Kautschuk | Phenolharzes, Melaminharze, Polyesterharze, Silikone, | Polyurethane, Epoxidharze |
| Thermoplaste sind beim Erwärmen verformbar | lineare oder verzweigte Kohlenstoffketten | Polyethen (PE), Polypropylen (PP), Polystyrol (PS), Polyvinylchlorid (PVC) | Polyamiden, Polyester, Polycarbonate, | (lineare) Polyurethane |
Vergleich der „Plaste“ (Thermoplast & Duroplast)
Verwendung der Plaste:
- Tonbänder, Kassetten, Disketten, Speichermedien
- Kunststoffbrillengläser
- Medizin (Zahnprothese, Sehnenersatz, Knochenersatz...)
| Thermoplast | Duroplast |
|---|---|
| * erweicht beim Erwärmen | * zersetzt sich beim Erwärmen |
| * ist plastisch verformbar | * ist nicht plastisch verformbar |
Kunststoffrecycling
Versuch zum CD Recycling
a) CD Recycling
Material: Schere, 2 Glasschalen, Plätzchenform, Pinzette, Schlifffett, sonstiges Labormaterial, Alufolie
Schutzvorkehrungen beachten: Abzug, Kittel, Handschuhe, Schutzbrille!
- V:
- Eine CD mit 40ml konzentrierte Salpetersäure übergießen. (Vorsicht nitrose Gase entstehen!)
- Nach 2min hat sich die obere Lackschicht gelöst. Reste evtl. mit einer Pinzette, einem Glasstab oder einem Kunststoffspatel entfernen. Man erkennt die freie Aluminiumschicht.
- Zugabe von 40ml konzentrierter Salzsäure. Die Aluminiumschicht wird so abgelöst. Zurück bleibt die Polycarbonat Scheibe
- Die Scheibe in ein zweites Gefäß geben und unter fließend Wasser reinigen.
- Ein Teil der Polycarbonatscheibe wird mit einer Schere in ca. 1cm2 große Schnipsel geschnitten.
- Man erhitzt auf einer heißen Platte (Keramik- oder Ceranplatte) bedeckt diese mit Aluminiumfolie und schmilzt die Polycarbonatschnipsel in einer (vorher mit Schlifffett gefetteten) Plätzchenform aus Metall (max. 1cm hoch befüllen).
- Wenn man möchte, kann man das noch heiße Polycarbonat mit Thymolblau oder Methylrot färben.
Chemiefasern
Man unterscheidet:
Natürliche „Chemiefasern“: Aramid, Elastan, Elastodien, Fluoro, Modacryl, Polyacryl, Polyamid, Polyester, Polyethylen, Polypropylen, Polyvinylalkohol, Polyvinylchlorid, Polyvinylidenchlorid,
Synthetische „Chemiefasern“
zellulosische Chemiefasern:
- Viskose
- Modal
- Cupro
- Acetat
- Triacetat
- Alginat
- Gummi
- ↑ Vergleiche: auch bei Diamanten sind die Kohlenstoffe untereinander stark vernetzt.
Lizenzbestimmungen
Creative Commons Attribution Share-Alike 3.0 Unported
Deed

Diese "Commons Deed" ist lediglich eine vereinfachte Zusammenfassung des rechtsverbindlichen Lizenzvertrages (Abschnitt "License") in allgemeinverständlicher Sprache.
Sie dürfen:
- das Werk bzw. den Inhalt vervielfältigen, verbreiten und öffentlich zugänglich machen
- Abwandlungen und Bearbeitungen des Werkes bzw. Inhaltes anfertigen
Zu den folgenden Bedingungen:


- Namensnennung — Sie müssen den Namen des Autors/Rechteinhabers in der von ihm festgelegten Weise nennen.
- Weitergabe unter gleichen Bedingungen — Wenn Sie das lizenzierte Werk bzw. den lizenzierten Inhalt bearbeiten, abwandeln oder in anderer Weise erkennbar als Grundlage für eigenes Schaffen verwenden, dürfen Sie die daraufhin neu entstandenen Werke bzw. Inhalte nur unter Verwendung von Lizenzbedingungen weitergeben, die mit denen dieses Lizenzvertrages identisch, vergleichbar oder kompatibel sind.
Wobei gilt:
- Verzichtserklärung — Jede der vorgenannten Bedingungen kann aufgehoben werden, sofern Sie die ausdrückliche Einwilligung des Rechteinhabers dazu erhalten.
- Sonstige Rechte — Die Lizenz hat keinerlei Einfluss auf die folgenden Rechte:
- Die gesetzlichen Schranken des Urheberrechts und sonstigen Befugnisse zur privaten Nutzung;
- Das Urheberpersönlichkeitsrecht des Rechteinhabers;
- Rechte anderer Personen, entweder am Lizenzgegenstand selber oder bezüglich seiner Verwendung, zum Beispiel Persönlichkeitsrechte abgebildeter Personen.
- Hinweis — Im Falle einer Verbreitung müssen Sie anderen alle Lizenzbedingungen mitteilen, die für dieses Werk gelten. Am einfachsten ist es, an entsprechender Stelle einen Link auf http://creativecommons.org/licenses/by-sa/3.0/deed.de einzubinden.
Haftungsbeschränkung
Die „Commons Deed“ ist kein Lizenzvertrag. Sie ist lediglich ein Referenztext, der den zugrundeliegenden Lizenzvertrag übersichtlich und in allgemeinverständlicher Sprache aber auch stark vereinfacht wiedergibt. Die Deed selbst entfaltet keine juristische Wirkung und erscheint im eigentlichen Lizenzvertrag nicht.
License
CREATIVE COMMONS CORPORATION IS NOT A LAW FIRM AND DOES NOT PROVIDE LEGAL SERVICES. DISTRIBUTION OF THIS LICENSE DOES NOT CREATE AN ATTORNEY-CLIENT RELATIONSHIP. CREATIVE COMMONS PROVIDES THIS INFORMATION ON AN "AS-IS" BASIS. CREATIVE COMMONS MAKES NO WARRANTIES REGARDING THE INFORMATION PROVIDED, AND DISCLAIMS LIABILITY FOR DAMAGES RESULTING FROM ITS USE.}}
THE WORK (AS DEFINED BELOW) IS PROVIDED UNDER THE TERMS OF THIS CREATIVE COMMONS PUBLIC LICENSE ("CCPL" OR "LICENSE"). THE WORK IS PROTECTED BY COPYRIGHT AND/OR OTHER APPLICABLE LAW. ANY USE OF THE WORK OTHER THAN AS AUTHORIZED UNDER THIS LICENSE OR COPYRIGHT LAW IS PROHIBITED.
BY EXERCISING ANY RIGHTS TO THE WORK PROVIDED HERE, YOU ACCEPT AND AGREE TO BE BOUND BY THE TERMS OF THIS LICENSE. TO THE EXTENT THIS LICENSE MAY BE CONSIDERED TO BE A CONTRACT, THE LICENSOR GRANTS YOU THE RIGHTS CONTAINED HERE IN CONSIDERATION OF YOUR ACCEPTANCE OF SUCH TERMS AND CONDITIONS.
1. Definitions
- "Adaptation" means a work based upon the Work, or upon the Work and other pre-existing works, such as a translation, adaptation, derivative work, arrangement of music or other alterations of a literary or artistic work, or phonogram or performance and includes cinematographic adaptations or any other form in which the Work may be recast, transformed, or adapted including in any form recognizably derived from the original, except that a work that constitutes a Collection will not be considered an Adaptation for the purpose of this License. For the avoidance of doubt, where the Work is a musical work, performance or phonogram, the synchronization of the Work in timed-relation with a moving image ("synching") will be considered an Adaptation for the purpose of this License.
- "Collection" means a collection of literary or artistic works, such as encyclopedias and anthologies, or performances, phonograms or broadcasts, or other works or subject matter other than works listed in Section 1(f) below, which, by reason of the selection and arrangement of their contents, constitute intellectual creations, in which the Work is included in its entirety in unmodified form along with one or more other contributions, each constituting separate and independent works in themselves, which together are assembled into a collective whole. A work that constitutes a Collection will not be considered an Adaptation (as defined below) for the purposes of this License.
- "Creative Commons Compatible License" means a license that is listed at http://creativecommons.org/compatiblelicenses that has been approved by Creative Commons as being essentially equivalent to this License, including, at a minimum, because that license: (i) contains terms that have the same purpose, meaning and effect as the License Elements of this License; and, (ii) explicitly permits the relicensing of adaptations of works made available under that license under this License or a Creative Commons jurisdiction license with the same License Elements as this License.
- "Distribute" means to make available to the public the original and copies of the Work or Adaptation, as appropriate, through sale or other transfer of ownership.
- "License Elements" means the following high-level license attributes as selected by Licensor and indicated in the title of this License: Attribution, ShareAlike.
- "Licensor" means the individual, individuals, entity or entities that offer(s) the Work under the terms of this License.
- "Original Author" means, in the case of a literary or artistic work, the individual, individuals, entity or entities who created the Work or if no individual or entity can be identified, the publisher; and in addition (i) in the case of a performance the actors, singers, musicians, dancers, and other persons who act, sing, deliver, declaim, play in, interpret or otherwise perform literary or artistic works or expressions of folklore; (ii) in the case of a phonogram the producer being the person or legal entity who first fixes the sounds of a performance or other sounds; and, (iii) in the case of broadcasts, the organization that transmits the broadcast.
- "Work" means the literary and/or artistic work offered under the terms of this License including without limitation any production in the literary, scientific and artistic domain, whatever may be the mode or form of its expression including digital form, such as a book, pamphlet and other writing; a lecture, address, sermon or other work of the same nature; a dramatic or dramatico-musical work; a choreographic work or entertainment in dumb show; a musical composition with or without words; a cinematographic work to which are assimilated works expressed by a process analogous to cinematography; a work of drawing, painting, architecture, sculpture, engraving or lithography; a photographic work to which are assimilated works expressed by a process analogous to photography; a work of applied art; an illustration, map, plan, sketch or three-dimensional work relative to geography, topography, architecture or science; a performance; a broadcast; a phonogram; a compilation of data to the extent it is protected as a copyrightable work; or a work performed by a variety or circus performer to the extent it is not otherwise considered a literary or artistic work.
- "You" means an individual or entity exercising rights under this License who has not previously violated the terms of this License with respect to the Work, or who has received express permission from the Licensor to exercise rights under this License despite a previous violation.
- "Publicly Perform" means to perform public recitations of the Work and to communicate to the public those public recitations, by any means or process, including by wire or wireless means or public digital performances; to make available to the public Works in such a way that members of the public may access these Works from a place and at a place individually chosen by them; to perform the Work to the public by any means or process and the communication to the public of the performances of the Work, including by public digital performance; to broadcast and rebroadcast the Work by any means including signs, sounds or images.
- "Reproduce" means to make copies of the Work by any means including without limitation by sound or visual recordings and the right of fixation and reproducing fixations of the Work, including storage of a protected performance or phonogram in digital form or other electronic medium.
2. Fair Dealing Rights
Nothing in this License is intended to reduce, limit, or restrict any uses free from copyright or rights arising from limitations or exceptions that are provided for in connection with the copyright protection under copyright law or other applicable laws.
3. License Grant
Subject to the terms and conditions of this License, Licensor hereby grants You a worldwide, royalty-free, non-exclusive, perpetual (for the duration of the applicable copyright) license to exercise the rights in the Work as stated below:
- to Reproduce the Work, to incorporate the Work into one or more Collections, and to Reproduce the Work as incorporated in the Collections;
- to create and Reproduce Adaptations provided that any such Adaptation, including any translation in any medium, takes reasonable steps to clearly label, demarcate or otherwise identify that changes were made to the original Work. For example, a translation could be marked "The original work was translated from English to Spanish," or a modification could indicate "The original work has been modified.";
- to Distribute and Publicly Perform the Work including as incorporated in Collections; and,
- to Distribute and Publicly Perform Adaptations.
- For the avoidance of doubt:
- Non-waivable Compulsory License Schemes. In those jurisdictions in which the right to collect royalties through any statutory or compulsory licensing scheme cannot be waived, the Licensor reserves the exclusive right to collect such royalties for any exercise by You of the rights granted under this License;
- Waivable Compulsory License Schemes. In those jurisdictions in which the right to collect royalties through any statutory or compulsory licensing scheme can be waived, the Licensor waives the exclusive right to collect such royalties for any exercise by You of the rights granted under this License; and,
- Voluntary License Schemes. The Licensor waives the right to collect royalties, whether individually or, in the event that the Licensor is a member of a collecting society that administers voluntary licensing schemes, via that society, from any exercise by You of the rights granted under this License.
The above rights may be exercised in all media and formats whether now known or hereafter devised. The above rights include the right to make such modifications as are technically necessary to exercise the rights in other media and formats. Subject to Section 8(f), all rights not expressly granted by Licensor are hereby reserved.
4. Restrictions
The license granted in Section 3 above is expressly made subject to and limited by the following restrictions:
- You may Distribute or Publicly Perform the Work only under the terms of this License. You must include a copy of, or the Uniform Resource Identifier (URI) for, this License with every copy of the Work You Distribute or Publicly Perform. You may not offer or impose any terms on the Work that restrict the terms of this License or the ability of the recipient of the Work to exercise the rights granted to that recipient under the terms of the License. You may not sublicense the Work. You must keep intact all notices that refer to this License and to the disclaimer of warranties with every copy of the Work You Distribute or Publicly Perform. When You Distribute or Publicly Perform the Work, You may not impose any effective technological measures on the Work that restrict the ability of a recipient of the Work from You to exercise the rights granted to that recipient under the terms of the License. This Section 4(a) applies to the Work as incorporated in a Collection, but this does not require the Collection apart from the Work itself to be made subject to the terms of this License. If You create a Collection, upon notice from any Licensor You must, to the extent practicable, remove from the Collection any credit as required by Section 4(c), as requested. If You create an Adaptation, upon notice from any Licensor You must, to the extent practicable, remove from the Adaptation any credit as required by Section 4(c), as requested.
- You may Distribute or Publicly Perform an Adaptation only under the terms of: (i) this License; (ii) a later version of this License with the same License Elements as this License; (iii) a Creative Commons jurisdiction license (either this or a later license version) that contains the same License Elements as this License (e.g., Attribution-ShareAlike 3.0 US)); (iv) a Creative Commons Compatible License. If you license the Adaptation under one of the licenses mentioned in (iv), you must comply with the terms of that license. If you license the Adaptation under the terms of any of the licenses mentioned in (i), (ii) or (iii) (the "Applicable License"), you must comply with the terms of the Applicable License generally and the following provisions: (I) You must include a copy of, or the URI for, the Applicable License with every copy of each Adaptation You Distribute or Publicly Perform; (II) You may not offer or impose any terms on the Adaptation that restrict the terms of the Applicable License or the ability of the recipient of the Adaptation to exercise the rights granted to that recipient under the terms of the Applicable License; (III) You must keep intact all notices that refer to the Applicable License and to the disclaimer of warranties with every copy of the Work as included in the Adaptation You Distribute or Publicly Perform; (IV) when You Distribute or Publicly Perform the Adaptation, You may not impose any effective technological measures on the Adaptation that restrict the ability of a recipient of the Adaptation from You to exercise the rights granted to that recipient under the terms of the Applicable License. This Section 4(b) applies to the Adaptation as incorporated in a Collection, but this does not require the Collection apart from the Adaptation itself to be made subject to the terms of the Applicable License.
- If You Distribute, or Publicly Perform the Work or any Adaptations or Collections, You must, unless a request has been made pursuant to Section 4(a), keep intact all copyright notices for the Work and provide, reasonable to the medium or means You are utilizing: (i) the name of the Original Author (or pseudonym, if applicable) if supplied, and/or if the Original Author and/or Licensor designate another party or parties (e.g., a sponsor institute, publishing entity, journal) for attribution ("Attribution Parties") in Licensor's copyright notice, terms of service or by other reasonable means, the name of such party or parties; (ii) the title of the Work if supplied; (iii) to the extent reasonably practicable, the URI, if any, that Licensor specifies to be associated with the Work, unless such URI does not refer to the copyright notice or licensing information for the Work; and (iv) , consistent with Section 3(b), in the case of an Adaptation, a credit identifying the use of the Work in the Adaptation (e.g., "French translation of the Work by Original Author," or "Screenplay based on original Work by Original Author"). The credit required by this Section 4(c) may be implemented in any reasonable manner; provided, however, that in the case of a Adaptation or Collection, at a minimum such credit will appear, if a credit for all contributing authors of the Adaptation or Collection appears, then as part of these credits and in a manner at least as prominent as the credits for the other contributing authors. For the avoidance of doubt, You may only use the credit required by this Section for the purpose of attribution in the manner set out above and, by exercising Your rights under this License, You may not implicitly or explicitly assert or imply any connection with, sponsorship or endorsement by the Original Author, Licensor and/or Attribution Parties, as appropriate, of You or Your use of the Work, without the separate, express prior written permission of the Original Author, Licensor and/or Attribution Parties.
- Except as otherwise agreed in writing by the Licensor or as may be otherwise permitted by applicable law, if You Reproduce, Distribute or Publicly Perform the Work either by itself or as part of any Adaptations or Collections, You must not distort, mutilate, modify or take other derogatory action in relation to the Work which would be prejudicial to the Original Author's honor or reputation. Licensor agrees that in those jurisdictions (e.g. Japan), in which any exercise of the right granted in Section 3(b) of this License (the right to make Adaptations) would be deemed to be a distortion, mutilation, modification or other derogatory action prejudicial to the Original Author's honor and reputation, the Licensor will waive or not assert, as appropriate, this Section, to the fullest extent permitted by the applicable national law, to enable You to reasonably exercise Your right under Section 3(b) of this License (right to make Adaptations) but not otherwise.
5. Representations, Warranties and Disclaimer
UNLESS OTHERWISE MUTUALLY AGREED TO BY THE PARTIES IN WRITING, LICENSOR OFFERS THE WORK AS-IS AND MAKES NO REPRESENTATIONS OR WARRANTIES OF ANY KIND CONCERNING THE WORK, EXPRESS, IMPLIED, STATUTORY OR OTHERWISE, INCLUDING, WITHOUT LIMITATION, WARRANTIES OF TITLE, MERCHANTIBILITY, FITNESS FOR A PARTICULAR PURPOSE, NONINFRINGEMENT, OR THE ABSENCE OF LATENT OR OTHER DEFECTS, ACCURACY, OR THE PRESENCE OF ABSENCE OF ERRORS, WHETHER OR NOT DISCOVERABLE. SOME JURISDICTIONS DO NOT ALLOW THE EXCLUSION OF IMPLIED WARRANTIES, SO SUCH EXCLUSION MAY NOT APPLY TO YOU.
6. Limitation on Liability.
EXCEPT TO THE EXTENT REQUIRED BY APPLICABLE LAW, IN NO EVENT WILL LICENSOR BE LIABLE TO YOU ON ANY LEGAL THEORY FOR ANY SPECIAL, INCIDENTAL, CONSEQUENTIAL, PUNITIVE OR EXEMPLARY DAMAGES ARISING OUT OF THIS LICENSE OR THE USE OF THE WORK, EVEN IF LICENSOR HAS BEEN ADVISED OF THE POSSIBILITY OF SUCH DAMAGES.
7. Termination
- This License and the rights granted hereunder will terminate automatically upon any breach by You of the terms of this License. Individuals or entities who have received Adaptations or Collections from You under this License, however, will not have their licenses terminated provided such individuals or entities remain in full compliance with those licenses. Sections 1, 2, 5, 6, 7, and 8 will survive any termination of this License.
- Subject to the above terms and conditions, the license granted here is perpetual (for the duration of the applicable copyright in the Work). Notwithstanding the above, Licensor reserves the right to release the Work under different license terms or to stop distributing the Work at any time; provided, however that any such election will not serve to withdraw this License (or any other license that has been, or is required to be, granted under the terms of this License), and this License will continue in full force and effect unless terminated as stated above.
8. Miscellaneous
- Each time You Distribute or Publicly Perform the Work or a Collection, the Licensor offers to the recipient a license to the Work on the same terms and conditions as the license granted to You under this License.
- Each time You Distribute or Publicly Perform an Adaptation, Licensor offers to the recipient a license to the original Work on the same terms and conditions as the license granted to You under this License.
- If any provision of this License is invalid or unenforceable under applicable law, it shall not affect the validity or enforceability of the remainder of the terms of this License, and without further action by the parties to this agreement, such provision shall be reformed to the minimum extent necessary to make such provision valid and enforceable.
- No term or provision of this License shall be deemed waived and no breach consented to unless such waiver or consent shall be in writing and signed by the party to be charged with such waiver or consent.
- This License constitutes the entire agreement between the parties with respect to the Work licensed here. There are no understandings, agreements or representations with respect to the Work not specified here. Licensor shall not be bound by any additional provisions that may appear in any communication from You. This License may not be modified without the mutual written agreement of the Licensor and You.
- The rights granted under, and the subject matter referenced, in this License were drafted utilizing the terminology of the Berne Convention for the Protection of Literary and Artistic Works (as amended on September 28, 1979), the Rome Convention of 1961, the WIPO Copyright Treaty of 1996, the WIPO Performances and Phonograms Treaty of 1996 and the Universal Copyright Convention (as revised on July 24, 1971). These rights and subject matter take effect in the relevant jurisdiction in which the License terms are sought to be enforced according to the corresponding provisions of the implementation of those treaty provisions in the applicable national law. If the standard suite of rights granted under applicable copyright law includes additional rights not granted under this License, such additional rights are deemed to be included in the License; this License is not intended to restrict the license of any rights under applicable law.
Creative Commons Notice
Creative Commons is not a party to this License, and makes no warranty whatsoever in connection with the Work. Creative Commons will not be liable to You or any party on any legal theory for any damages whatsoever, including without limitation any general, special, incidental or consequential damages arising in connection to this license. Notwithstanding the foregoing two (2) sentences, if Creative Commons has expressly identified itself as the Licensor hereunder, it shall have all rights and obligations of Licensor.
Except for the limited purpose of indicating to the public that the Work is licensed under the CCPL, Creative Commons does not authorize the use by either party of the trademark "Creative Commons" or any related trademark or logo of Creative Commons without the prior written consent of Creative Commons. Any permitted use will be in compliance with Creative Commons' then-current trademark usage guidelines, as may be published on its website or otherwise made available upon request from time to time. For the avoidance of doubt, this trademark restriction does not form part of the License.
Creative Commons may be contacted at http://creativecommons.org/.
GNU Free Documentation License
Version 1.2, November 2002
Copyright (C) 2000,2001,2002 Free Software Foundation, Inc.
51 Franklin St, Fifth Floor, Boston, MA 02110-1301 USA
Everyone is permitted to copy and distribute verbatim copies
of this license document, but changing it is not allowed.
0. PREAMBLE
The purpose of this License is to make a manual, textbook, or other functional and useful document "free" in the sense of freedom: to assure everyone the effective freedom to copy and redistribute it, with or without modifying it, either commercially or noncommercially. Secondarily, this License preserves for the author and publisher a way to get credit for their work, while not being considered responsible for modifications made by others.
This License is a kind of "copyleft", which means that derivative works of the document must themselves be free in the same sense. It complements the GNU General Public License, which is a copyleft license designed for free software.
We have designed this License in order to use it for manuals for free software, because free software needs free documentation: a free program should come with manuals providing the same freedoms that the software does. But this License is not limited to software manuals; it can be used for any textual work, regardless of subject matter or whether it is published as a printed book. We recommend this License principally for works whose purpose is instruction or reference.
1. APPLICABILITY AND DEFINITIONS
This License applies to any manual or other work, in any medium, that contains a notice placed by the copyright holder saying it can be distributed under the terms of this License. Such a notice grants a world-wide, royalty-free license, unlimited in duration, to use that work under the conditions stated herein. The "Document", below, refers to any such manual or work. Any member of the public is a licensee, and is addressed as "you". You accept the license if you copy, modify or distribute the work in a way requiring permission under copyright law.
A "Modified Version" of the Document means any work containing the Document or a portion of it, either copied verbatim, or with modifications and/or translated into another language.
A "Secondary Section" is a named appendix or a front-matter section of the Document that deals exclusively with the relationship of the publishers or authors of the Document to the Document's overall subject (or to related matters) and contains nothing that could fall directly within that overall subject. (Thus, if the Document is in part a textbook of mathematics, a Secondary Section may not explain any mathematics.) The relationship could be a matter of historical connection with the subject or with related matters, or of legal, commercial, philosophical, ethical or political position regarding them.
The "Invariant Sections" are certain Secondary Sections whose titles are designated, as being those of Invariant Sections, in the notice that says that the Document is released under this License. If a section does not fit the above definition of Secondary then it is not allowed to be designated as Invariant. The Document may contain zero Invariant Sections. If the Document does not identify any Invariant Sections then there are none.
The "Cover Texts" are certain short passages of text that are listed, as Front-Cover Texts or Back-Cover Texts, in the notice that says that the Document is released under this License. A Front-Cover Text may be at most 5 words, and a Back-Cover Text may be at most 25 words.
A "Transparent" copy of the Document means a machine-readable copy, represented in a format whose specification is available to the general public, that is suitable for revising the document straightforwardly with generic text editors or (for images composed of pixels) generic paint programs or (for drawings) some widely available drawing editor, and that is suitable for input to text formatters or for automatic translation to a variety of formats suitable for input to text formatters. A copy made in an otherwise Transparent file format whose markup, or absence of markup, has been arranged to thwart or discourage subsequent modification by readers is not Transparent. An image format is not Transparent if used for any substantial amount of text. A copy that is not "Transparent" is called "Opaque".
Examples of suitable formats for Transparent copies include plain ASCII without markup, Texinfo input format, LaTeX input format, SGML or XML using a publicly available DTD, and standard-conforming simple HTML, PostScript or PDF designed for human modification. Examples of transparent image formats include PNG, XCF and JPG. Opaque formats include proprietary formats that can be read and edited only by proprietary word processors, SGML or XML for which the DTD and/or processing tools are not generally available, and the machine-generated HTML, PostScript or PDF produced by some word processors for output purposes only.
The "Title Page" means, for a printed book, the title page itself, plus such following pages as are needed to hold, legibly, the material this License requires to appear in the title page. For works in formats which do not have any title page as such, "Title Page" means the text near the most prominent appearance of the work's title, preceding the beginning of the body of the text.
A section "Entitled XYZ" means a named subunit of the Document whose title either is precisely XYZ or contains XYZ in parentheses following text that translates XYZ in another language. (Here XYZ stands for a specific section name mentioned below, such as "Acknowledgements", "Dedications", "Endorsements", or "History".) To "Preserve the Title" of such a section when you modify the Document means that it remains a section "Entitled XYZ" according to this definition.
The Document may include Warranty Disclaimers next to the notice which states that this License applies to the Document. These Warranty Disclaimers are considered to be included by reference in this License, but only as regards disclaiming warranties: any other implication that these Warranty Disclaimers may have is void and has no effect on the meaning of this License.
2. VERBATIM COPYING
You may copy and distribute the Document in any medium, either commercially or noncommercially, provided that this License, the copyright notices, and the license notice saying this License applies to the Document are reproduced in all copies, and that you add no other conditions whatsoever to those of this License. You may not use technical measures to obstruct or control the reading or further copying of the copies you make or distribute. However, you may accept compensation in exchange for copies. If you distribute a large enough number of copies you must also follow the conditions in section 3.
You may also lend copies, under the same conditions stated above, and you may publicly display copies.
3. COPYING IN QUANTITY
If you publish printed copies (or copies in media that commonly have printed covers) of the Document, numbering more than 100, and the Document's license notice requires Cover Texts, you must enclose the copies in covers that carry, clearly and legibly, all these Cover Texts: Front-Cover Texts on the front cover, and Back-Cover Texts on the back cover. Both covers must also clearly and legibly identify you as the publisher of these copies. The front cover must present the full title with all words of the title equally prominent and visible. You may add other material on the covers in addition. Copying with changes limited to the covers, as long as they preserve the title of the Document and satisfy these conditions, can be treated as verbatim copying in other respects.
If the required texts for either cover are too voluminous to fit legibly, you should put the first ones listed (as many as fit reasonably) on the actual cover, and continue the rest onto adjacent pages.
If you publish or distribute Opaque copies of the Document numbering more than 100, you must either include a machine-readable Transparent copy along with each Opaque copy, or state in or with each Opaque copy a computer-network location from which the general network-using public has access to download using public-standard network protocols a complete Transparent copy of the Document, free of added material. If you use the latter option, you must take reasonably prudent steps, when you begin distribution of Opaque copies in quantity, to ensure that this Transparent copy will remain thus accessible at the stated location until at least one year after the last time you distribute an Opaque copy (directly or through your agents or retailers) of that edition to the public.
It is requested, but not required, that you contact the authors of the Document well before redistributing any large number of copies, to give them a chance to provide you with an updated version of the Document.
4. MODIFICATIONS
You may copy and distribute a Modified Version of the Document under the conditions of sections 2 and 3 above, provided that you release the Modified Version under precisely this License, with the Modified Version filling the role of the Document, thus licensing distribution and modification of the Modified Version to whoever possesses a copy of it. In addition, you must do these things in the Modified Version:
- A. Use in the Title Page (and on the covers, if any) a title distinct from that of the Document, and from those of previous versions (which should, if there were any, be listed in the History section of the Document). You may use the same title as a previous version if the original publisher of that version gives permission.
- B. List on the Title Page, as authors, one or more persons or entities responsible for authorship of the modifications in the Modified Version, together with at least five of the principal authors of the Document (all of its principal authors, if it has fewer than five), unless they release you from this requirement.
- C. State on the Title page the name of the publisher of the Modified Version, as the publisher.
- D. Preserve all the copyright notices of the Document.
- E. Add an appropriate copyright notice for your modifications adjacent to the other copyright notices.
- F. Include, immediately after the copyright notices, a license notice giving the public permission to use the Modified Version under the terms of this License, in the form shown in the Addendum below.
- G. Preserve in that license notice the full lists of Invariant Sections and required Cover Texts given in the Document's license notice.
- H. Include an unaltered copy of this License.
- I. Preserve the section Entitled "History", Preserve its Title, and add to it an item stating at least the title, year, new authors, and publisher of the Modified Version as given on the Title Page. If there is no section Entitled "History" in the Document, create one stating the title, year, authors, and publisher of the Document as given on its Title Page, then add an item describing the Modified Version as stated in the previous sentence.
- J. Preserve the network location, if any, given in the Document for public access to a Transparent copy of the Document, and likewise the network locations given in the Document for previous versions it was based on. These may be placed in the "History" section. You may omit a network location for a work that was published at least four years before the Document itself, or if the original publisher of the version it refers to gives permission.
- K. For any section Entitled "Acknowledgements" or "Dedications", Preserve the Title of the section, and preserve in the section all the substance and tone of each of the contributor acknowledgements and/or dedications given therein.
- L. Preserve all the Invariant Sections of the Document, unaltered in their text and in their titles. Section numbers or the equivalent are not considered part of the section titles.
- M. Delete any section Entitled "Endorsements". Such a section may not be included in the Modified Version.
- N. Do not retitle any existing section to be Entitled "Endorsements" or to conflict in title with any Invariant Section.
- O. Preserve any Warranty Disclaimers.
If the Modified Version includes new front-matter sections or appendices that qualify as Secondary Sections and contain no material copied from the Document, you may at your option designate some or all of these sections as invariant. To do this, add their titles to the list of Invariant Sections in the Modified Version's license notice. These titles must be distinct from any other section titles.
You may add a section Entitled "Endorsements", provided it contains nothing but endorsements of your Modified Version by various parties--for example, statements of peer review or that the text has been approved by an organization as the authoritative definition of a standard.
You may add a passage of up to five words as a Front-Cover Text, and a passage of up to 25 words as a Back-Cover Text, to the end of the list of Cover Texts in the Modified Version. Only one passage of Front-Cover Text and one of Back-Cover Text may be added by (or through arrangements made by) any one entity. If the Document already includes a cover text for the same cover, previously added by you or by arrangement made by the same entity you are acting on behalf of, you may not add another; but you may replace the old one, on explicit permission from the previous publisher that added the old one.
The author(s) and publisher(s) of the Document do not by this License give permission to use their names for publicity for or to assert or imply endorsement of any Modified Version.
5. COMBINING DOCUMENTS
You may combine the Document with other documents released under this License, under the terms defined in section 4 above for modified versions, provided that you include in the combination all of the Invariant Sections of all of the original documents, unmodified, and list them all as Invariant Sections of your combined work in its license notice, and that you preserve all their Warranty Disclaimers.
The combined work need only contain one copy of this License, and multiple identical Invariant Sections may be replaced with a single copy. If there are multiple Invariant Sections with the same name but different contents, make the title of each such section unique by adding at the end of it, in parentheses, the name of the original author or publisher of that section if known, or else a unique number. Make the same adjustment to the section titles in the list of Invariant Sections in the license notice of the combined work.
In the combination, you must combine any sections Entitled "History" in the various original documents, forming one section Entitled "History"; likewise combine any sections Entitled "Acknowledgements", and any sections Entitled "Dedications". You must delete all sections Entitled "Endorsements."
6. COLLECTIONS OF DOCUMENTS
You may make a collection consisting of the Document and other documents released under this License, and replace the individual copies of this License in the various documents with a single copy that is included in the collection, provided that you follow the rules of this License for verbatim copying of each of the documents in all other respects.
You may extract a single document from such a collection, and distribute it individually under this License, provided you insert a copy of this License into the extracted document, and follow this License in all other respects regarding verbatim copying of that document.
7. AGGREGATION WITH INDEPENDENT WORKS
A compilation of the Document or its derivatives with other separate and independent documents or works, in or on a volume of a storage or distribution medium, is called an "aggregate" if the copyright resulting from the compilation is not used to limit the legal rights of the compilation's users beyond what the individual works permit. When the Document is included in an aggregate, this License does not apply to the other works in the aggregate which are not themselves derivative works of the Document.
If the Cover Text requirement of section 3 is applicable to these copies of the Document, then if the Document is less than one half of the entire aggregate, the Document's Cover Texts may be placed on covers that bracket the Document within the aggregate, or the electronic equivalent of covers if the Document is in electronic form. Otherwise they must appear on printed covers that bracket the whole aggregate.
8. TRANSLATION
Translation is considered a kind of modification, so you may distribute translations of the Document under the terms of section 4. Replacing Invariant Sections with translations requires special permission from their copyright holders, but you may include translations of some or all Invariant Sections in addition to the original versions of these Invariant Sections. You may include a translation of this License, and all the license notices in the Document, and any Warranty Disclaimers, provided that you also include the original English version of this License and the original versions of those notices and disclaimers. In case of a disagreement between the translation and the original version of this License or a notice or disclaimer, the original version will prevail.
If a section in the Document is Entitled "Acknowledgements", "Dedications", or "History", the requirement (section 4) to Preserve its Title (section 1) will typically require changing the actual title.
9. TERMINATION
You may not copy, modify, sublicense, or distribute the Document except as expressly provided for under this License. Any other attempt to copy, modify, sublicense or distribute the Document is void, and will automatically terminate your rights under this License. However, parties who have received copies, or rights, from you under this License will not have their licenses terminated so long as such parties remain in full compliance.
10. FUTURE REVISIONS OF THIS LICENSE
The Free Software Foundation may publish new, revised versions of the GNU Free Documentation License from time to time. Such new versions will be similar in spirit to the present version, but may differ in detail to address new problems or concerns. See http://www.gnu.org/copyleft/.
Each version of the License is given a distinguishing version number. If the Document specifies that a particular numbered version of this License "or any later version" applies to it, you have the option of following the terms and conditions either of that specified version or of any later version that has been published (not as a draft) by the Free Software Foundation. If the Document does not specify a version number of this License, you may choose any version ever published (not as a draft) by the Free Software Foundation.















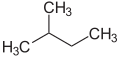



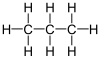










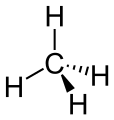












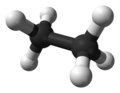


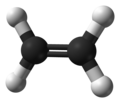



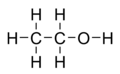












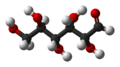


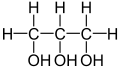








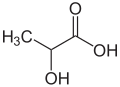



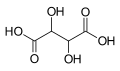

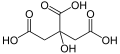




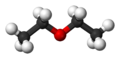


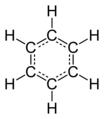



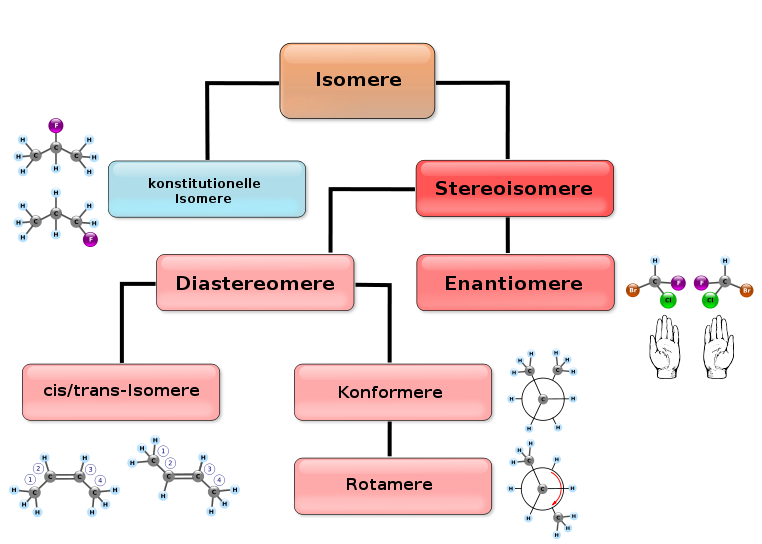



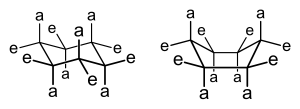










































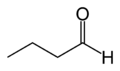



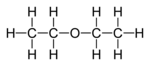








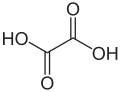

















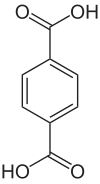





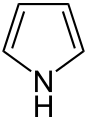
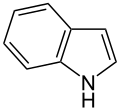
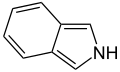

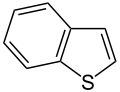
![Benzo[c]thiophen](http://upload.wikimedia.org/wikipedia/commons/thumb/9/95/Benzo_c_thiophen.svg/120px-Benzo_c_thiophen.svg.png)