Biochemie und Pathobiochemie: Ketosäure-Dehydrogenase-Komplexe
Allgemeines
[Bearbeiten]Bei der dehydrierenden Decarboxylierung von α-Ketosäuren in den Mitochondrien wird eine α-Ketosäure in mehreren Schritten unter NADH/H+-Gewinn decarboxyliert und der Säure-Rest auf Coenzym A übertragen. An den enzymatischen Reaktionen sind zahlreiche Cofaktoren beteiligt: Thiamin-Pyrophosphat (Vitamin B1), Coenzym A, FAD, NAD+ und proteingebundenes Lipoamid (Lipoyllysin).
Aufbau der Enzymkomplexe
[Bearbeiten]Die dehydrierende Decarboxylierung findet an verschiedenen Multienzymkomplexen statt, die aus je drei Untereinheiten, E1 bis E3, bestehen. E1 und E2 liegen in unterschiedlichen Isoformen vor, je nach Substrat, das umgesetzt werden soll.
| Pyruvat-Dehydrogenase-Komplex | α-Ketoglutarat-Dehydrogenase-Komplex | Verzweigtkettige-α-Ketosäuren-DH-Komplex (BCKDC) | ||||
|---|---|---|---|---|---|---|
| UE | Enzym | EC | Enzym | EC | Enzym | EC |
| E1 | Pyruvat-Dehydrogenase | 1.2.4.1 | α-Ketoglutarat-Dehydrogenase | 1.2.4.2 | Verzweigtkettige-α-Ketosäuren- Dehydrogenase | 1.2.4.4 |
| E2 | Dihydrolipoamid-S- Acetyltransferase | 2.3.1.12 | Dihydrolipoamid-S- Succinyltransferase | 2.3.1.61 | Dihydrolipoyl-Verzweigtkettigen- Transacylase | 2.3.1.168 |
| E3 | Dihydrolipoyl-Dehydrogenase | 1.8.1.4 | Dihydrolipoyl-Dehydrogenase | 1.8.1.4 | Dihydrolipoyl-Dehydrogenase | 1.8.1.4 |
Der BCKDC weist zwei regulatorische Enzyme, eine Kinase und eine Phosphatase, auf, die die Enzymaktivität durch kovalente Modifikation regulieren.
Stoffwechselwege
[Bearbeiten]- Pyruvat-Dehydrogenase-Komplex - Der PDH-Komplex katalysiert die dehydrierende Decarboxylierung von Pyruvat zu Acetyl-Coenzym A, die Vorreaktion des Citratzyklus.
- α-Ketoglutarat-Dehydrogenase-Komplex - Der α-Ketoglutarat-Dehydrogenase-Komplex katalysiert die dehydrierende Decarboxylierung von α-Ketoglutarat zu Succinyl-CoA im Citratzyklus und die dehydrierende Decarboxylierung von α-Ketoadipat zu Glutaryl-CoA im Lysin-Abbauweg.
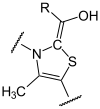
- Verzweigtkettige-α-Ketosäuren-Dehydrogenase-Komplex (branched-chain alpha-keto acid dehydrogenase complex (BCKD)) - Der Verzweigtkettige-α-Ketosäuren-Dehydrogenase-Komplex ist verantwortlich für den zweiten großen Schritt im Abbauweg der verzweigtkettigen Aminosäuren Valin, Leucin und Isoleucin.
Einzelreaktionen
[Bearbeiten]E1: Thiamin-abhängige Decarboxylierung der α-Ketosäure und Übertragung auf den Lipoyl-Rest
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Enzym | EC | EG | Erkr. | ||||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
|
|
Pyruvat-Dehydrogenase | 1.2.4.1 | Ox | PDH-E1-alpha-Def., PDH-E1-beta-Def. | |||||
| α-Ketoglutarat- Dehydrogenase | 1.2.4.2 | Ox | αKGDH-Def. | |||||||
| Verzweigtkettige- α-Ketosäuren- Dehydrogenase | 1.2.4.4 | Ox | MSUD I | |||||||
|
||||||||||
|
|
|
" | " | " | " | |||||
|
||||||||||
|
|
" | " | " | " | |||||
|
||||||||||
|
|
" | " | " | " | |||||
|
||||||||||
E2: Übertragung des Acyl-Restes auf Coenzym A
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|
|
|||||||||
| CoA-SH
Acyl-CoA |
Dihydrolipoamid-S-Acetyltransferase | 2.3.1.12 | Tr | PDHE2-Def. | |||||
| Dihydrolipoamid-S-Succinyltransferase | 2.3.1.61 | ||||||||
| Dihydrolipoyl-Verzweigtkettigen-Transacylase | 2.3.1.168 | MSUD II | |||||||
|
|||||||||
E3: Regeneration (Re-Oxidation) des Lipoyl-Restes
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|
|
|||||||||
|
Dihydrolipoyl-Dehydrogenase | Ox | MSUD III | ||||||
|
|||||||||
Literatur
[Bearbeiten]- Chuang DT, Chuang JL, Wynn RM. “Lessons from genetic disorders of branched-chain amino acid metabolism”. J. Nutr., 136:243S–9S, January 2006. PMID 16365091.
- Harris RA, Joshi M, Jeoung NH, Obayashi M. “Overview of the molecular and biochemical basis of branched-chain amino acid catabolism”. J. Nutr., 135:1527S–30S, June 2005. PMID 15930464.
Weblinks
[Bearbeiten]
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.