Biochemie und Pathobiochemie: Hexosemonophosphatweg
Allgemeines
[Bearbeiten]Der Hexosemonophosphatweg (HMP-Weg, Pentosephosphatweg, Pentosephosphat-Shunt) ist ein Nebenweg der Glycolyse. Er dient der Reduktion von NADPH + H+ für Reduktionsvorgänge und der Biosynthese von Ribose-5-phosphat für die Nukleotid- resp. Purin- und Pyrimidin-Biosynthese einschl. Purin-Salvage.
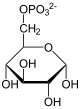
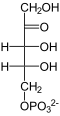
1. Teil: Oxidation und Decarboxylierung von α-D-Glucose-6-phosphat zu Ribulose-5-phosphat
[Bearbeiten]| All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | ||
|---|---|---|---|---|---|---|---|---|---|---|
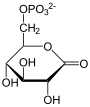
| 6-Phospho- gluconat |
|
5.3.1.9 | Iso | Glucose-6-phosphat-Isomerase-Defizienz | ||||||
| NADP+ | Glucose-6-phosphat- 1-Dehydrogenase (G6PD) | 1.1.1.49 | Ox | Glucose-6-phosphat-Dehydrogenase-Mangel | ||||||
| H2O
|
6-Phosphogluconolactonase | 3.1.1.31 | Hyd | |||||||
| NADP+ | 6-Phosphogluconat- Dehydrogenase | 1.1.1.44 | Ox | 6-Phosphogluconat-Dehydrogenase-Defizienz | ||||||
|
|
||||||||||
2. Teil: Aus Ribulose-5-phosphat wird Fructose-6-phosphat und Glycerinaldehyd-3-phosphat
[Bearbeiten]| Substrat 1 | ⇓ ⇑ | Substrat 2 | Co. | Enzym(e) | EC | EG | Erkr. | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||
| 1. |
2. |
1) Ribulose- phosphat-3-Epimerase
2) Ribose-5- phosphat-Isomerase |
1) 5.1.3.1
2) 5.3.1.6 |
Iso | 2) Ribose-5-phosphat-Isomerase-Defizienz | ||||||||
|
+ |
|
|||||||||||
| Thiamin- P2 | Transketolase | 2.2.1.1 | Tr | Wernicke-Korsakoff-Syndrom | |||||||||
|
+ |
|
|||||||||||
| Transaldolase | 2.2.1.2 | Tr | Transaldolase-Defizienz | ||||||||||
|
+ |
|
|||||||||||
| ---- | |||||||||||||
|
+ | ||||||||||||
| Thiamin- P2 | Transketolase | 2.2.1.1 | Tr | Wernicke-Korsakoff-Syndrom | |||||||||
|
+ |
|
Die Reaktionen im Detail
[Bearbeiten]Der Hexosemonophosphatweg (HMP-Weg, Pentosephosphatweg) ist ein Nebenweg der Glycolyse und wie diese im Zytosol lokalisiert.
Phase 1 (Oxidative, nicht-reversible Phase):
- Zuerst wird α-D-Glucose-6-phosphat zu β-D-Glucose-6-phosphat isomerisiert.
- Die Glucose-6-phosphat-1-Dehydrogenase katalysiert danach die Oxidation am C1-Atom. Dabei wird ein NADPH/H+ gewonnen und es entsteht 6-Phosphogluconolacton.
- Durch Wasseraufnahme wird daraus unter Ringöffnung 6-Phosphogluconat.
- 6-Phosphogluconat kann nun ein weiteres Mal unter NADPH/H+-Gewinn oxidiert werden. Dabei entsteht ein instabiles Zwischenprodukt, das spontan zu Ribulose-5-phosphat decarboxyliert.
In der Summe wird also eine (Phospho-)Hexose zweimal oxidiert und zur (Phospho-)Pentose decarboxyliert.
Phase 2 (Nicht-oxidative, reversible Phase):
- Ribulose-5-phosphat wird sowohl zu Xylulose-5-phosphat als auch zu Ribose-5-phosphat isomerisiert.
- Beide Produkte können von der Transketolase zu D-Glycerinaldehyd-3-phosphat und Sedoheptulose-7-phosphat umgesetzt werden.
- Diese wiederum können mit Hilfe der Transaldolase zu β-D-Fructose-6-phosphat und Erythrose-4-phosphat reagieren.
- In einem weiteren Schritt kann Erythrose-4-phosphat unter Einfluss der Transketolase noch einmal mit Xylulose-5-phosphat (s.o.) in D-Glycerinaldehyd-3-phosphat und β-D-Fructose-6-phosphat umgewandelt werden, die beiden Endprodukte dieses Weges.
Im Endeffekt werden im HMP-Weg jeweils drei Glucosephosphat-Moleküle (3 C6-Körper = 18 C-Atome) decarboxyliert (es bleiben 18 - 3 = 15 C-Atome) und diese dann zu zwei Fructose-6-phosphat (2 C6-Körper = 12 C-Atome) und einem Glycerinaldehyd-3-phosphat (1 C3-Körper) umgesetzt.
Glycerinaldehyd-3-phosphat und Fructose-6-phosphat können wieder in die Glycolyse eingeschleust werden oder über die Gluconeogenese zu α-D-Glucose-6-phosphat umgesetzt werden. Durch letzteres entsteht ein Kreislauf, über den Glucose netto vollständig decarboxyliert werden kann. Pro Glucose-Molekül werden dabei 12 NADPH/H+ gewonnen.
Bedeutung des Hexosemonophosphatweges
[Bearbeiten]- Generierung von NADPH/H+ im 1. Teil:
- für NADPH-abhängige Biosynthesen wie z.B. Fettsäuren und Cholesterin.
- Insbesondere in den Erythrozyten wird das NADPH benötigt, um die Glutathionreduktase zu regenerieren. Dieses Enzym reduziert Glutathion, ein Tripeptid aus Glutamat, Glycin und Cystein, welches mit seiner reduzierten Sulfhydrylgruppe (SH-Gruppe von Cystein) Hämoglobin u. a. Proteine vor der Oxidation schützt.
- Generierung von Pentosen wie D-Ribose-5-phosphat z. B. für die Nucleotid- und Nucleinsäuresynthese. Dafür kann der 2. Teil des Hexosephosphatweges von D-Glycerinaldehyd-3-phosphat und D-Fructose-6-phosphat ausgehend auch einfach rückwärts ablaufen, wenn z.B. Pentosen, aber kein NADPH/H+ benötigt wird.
Regulation
[Bearbeiten]Der 1. Teil des HMP-Weges wird reguliert durch das Angebot an NADP+ (Aktivierung) und NADPH/H+ (Hemmung). Das Schrittmacherenzym ist dabei die Glucose-6-phosphat-Dehydrogenase. Die Reaktionen des 2. Teils sind reversibel und laufen entsprechend dem Angebot an Substraten von unten (aus der Glycolyse/Gluconeogenese) oder oben (aus dem oxidativen Teil) ab und in dem Maße, wie Ribose-5-phosphat aus dem Gleichgewicht entfernt wird bzw. in die Nucleotid-Biosynthese abfließt.
Pathobiochemie
[Bearbeiten]Der G6PD-Mangel führt bei oxidativem Stress mit H2O2-Bildung (Infektionen, Medikamente wie ASS, Sulfonamide, Malariamittel, Lebensmittel wie Saubohnen/Favabohnen) zur oxidativen Schädigung des Erythrozyten und zu hämolytischen Krisen (Favismus).
Weblinks
[Bearbeiten]- KEGG: Pentose phosphate pathway - Homo sapiens (human)
- The chemical logic behind... the Pentose-phosphate Pathway. By Prof. Doutor Pedro Silva.
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.