Biochemie und Pathobiochemie: Gluconeogenese
Allgemeines
[Bearbeiten]Die Gluconeogenese (Glucose-Neubildung) ist eine energieaufwendige Möglichkeit, die Glycolyse umzukehren. Sie wird neben dem Glycogen-Abbau vor allem von der Leber dazu genutzt, um den Blutzuckerspiegel konstant zu halten.
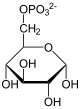
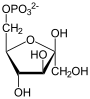
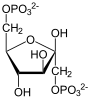
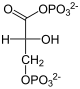
Teil 2: Bildung von Glucose aus Glycerinaldehyd-3-phosphat (GADP) und Dihydroxyacetonphosphat (DHAP)
[Bearbeiten]| Tr. | All. | ( ⇓ ) | Substrat | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||
|
+ cAMP |
Pi
H2O |
Glucose-6- Phosphatase | 3.1.3.9 | Hyd | GSD1a (von Gierke) | |||||||||
|
||||||||||||||
|
5.3.1.9 | Iso | GPI-Def. | |||||||||||
|
||||||||||||||
|
+ cAMP |
- AMP, F-2,6-BP | Pi
H2O |
Fructose-1,6- bisphosphatase | 3.1.3.11 | Hyd | FBP-Def. | ||||||||
|
||||||||||||||
| Zn |
|
4.1.2.13 | Ly | GSD12, Hered. Fructoseintoleranz | ||||||||||
|
|
5.3.1.1 | Iso | TPI1-Def. | ||||||||||
Teil 1: (Rück-)Gewinnung von Glycerinaldehyd-3-phosphat aus Pyruvat
[Bearbeiten]| Tr. | All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||
| Pi + NAD+ | NAD+ + Pi |
|
1.2.1.12 | Ox | ||||||||
|
||||||||||||
| ADP
ATP |
ADP
ATP |
|
2.7.2.3 | Tr | PGK1-Def. | |||||||
|
||||||||||||
|
5.4.2.1 | Iso | GSD10 | |||||||||
|
||||||||||||
|
|
|
Mg |
|
4.2.1.11 | Ly | ENO1-Def., GSD13 | ||||||
|
||||||||||||
|
+ cAMP, Gluko- kortikoide |
GDP, CO2
GTP |
Phosphoenolpyruvat- Carboxykinase | 4.1.1.32 | Ly | PCK1-Def., PCK2-Def. | |||||||
|
||||||||||||
| + Acetyl- CoA | ADP, Pi
ATP, HCO3- |
Biotin; Mn od. Zn | Pyruvat-Carboxylase | 6.4.1.1 | Lig | PC-Def. | ||||||
|
||||||||||||
| NADH/H+ | NADH/H+ | L-Lactat-Dehydrogenase | 1.1.1.27 | Ox | GSD11, LDHB-Def. | |||||||
|
||||||||||||
Die Gluconeogenese
[Bearbeiten]Die Gluconeogenese stellt quasi die Umkehrung der Glycolyse dar. Aus zwei Pyruvat (Lactat) wird hier ein Glucosemolekül gebildet. Um den Substratfluss in die entgegengesetzte Richtung zu leiten, müssen dabei drei irreversible exergone Reaktionen der Glycolyse gegen endergone ausgetauscht werden. Nicht zufällig stellen diese Reaktionen bzw. die katalysierenden Enzyme auch die Schlüsselenzyme dar, über die zwischen Glycolyse und Gluconeogenese hin- und hergeschaltet wird. Da die Gluconeogenese sehr energieaufwendig ist – sie kostet 6 Mol ATP (und 2 NADH/H+) pro Mol Glucose, während die Glycolyse nur 2 ATP (und 2 NADH/H+) pro Mol Glucose liefert – wird sie streng nach Bedarf aktiviert.
Die beteiligten Enzyme sind bis auf die Pyruvatcarboxylase (anaplerotische Reaktion des Citratzyklus im Mitochondrium) und die Glucose-6-Phosphatase (glattes endoplasmatisches Retikulum) im Zytosol lokalisiert. D.h. die Glucosebildung verteilt sich auf drei zelluläre Reaktionsräume.
Die Gluconeogenese findet v.a. in Leber und Nierenrinde, z.T. auch in der Darmmucosa statt. Sie dient neben der Glycogenolyse dazu, den Blutzuckerspiegel anzuheben und glucoseabhängige Organe wie Nervensystem, Erythrozyten, Nebennierenmark und den arbeitenden Skelettmuskel mit Glucose zu versorgen. Angekurbelt wird die Gluconeogenese besonders unter Belastung bzw. Stress durch sympathische Katecholaminfreisetzung (cAMP-Anstieg im Hepatozyt) und Glucokortikoide sowie Glucagon. Dies erfolgt über die Beeinflussung der Transkriptionsrate sowie über die Senkung der Konzentration an Fructose-2,6-bisphosphat, dem wichtigsten allosterischen Regulator. Insulin ist der Gegenspieler und bremst die Gluconeogenese.
Substrate der Gluconeogenese sind Lactat (Cori-Zyklus), glucogene Aminosäuren, die bes. aus dem Skelettmuskel zufließen (Glucose-Alanin-Zyklus), und Glycerin, welches beim Abbau von Triglyceriden, also bei der Lipolyse entsteht, nach Aktivierung und Oxidation zu Dihydroxyacetonphosphat. Die Gluconeogenese aus Acetyl-CoA ist hingegen nicht möglich, daher können Fettsäuren, Ketonkörper und rein ketogene Aminosäuren auch nicht zur Gluconeogenese herangezogen werden!
Verbindungen zu anderen Stoffwechselwegen
[Bearbeiten]Die Glycolyse der Nahrungsglucose bzw. Gluconeogenese aus Pyruvat, Lactat oder glucogenen Aminosäuren stellt als Rückgrat des Stoffwechsels zahlreichen anderen Stoffwechselwegen Substrat zur Verfügung und nimmt diese umgekehrt auch wieder auf. Die Verbindungen sind im Kapitel Glycolyse dargestellt. Der 1. Schritt der Gluconeogenese im Mitochondrium liefert anders als die Glycolyse zusätzlich noch Oxalacetat (Umgehung der Pyruvatkinase-Reaktion), womit der Citratzyklus (Mitochondrium) aufgefüllt werden kann bzw. umgekehrt kann das Oxalacetat aus dem Citratzyklus hier zur Gluconeogenese eingeschleust werden. Der Transport von Oxalacetat über die innere Mitochondrienmembran, die keinen Oxalacetat-Transporter hat, erfolgt z.B. in Form von Citrat (Kondensation von Oxalacetat mit Acetyl-CoA, 1. Reaktion des Citratzyklus) oder Malat (Reduktion von Oxalacetat zu Malat) mittels einem Tricarboxylatcarrier.
Pathobiochemie
[Bearbeiten]Bei der Glykogenspeicherkrankheit 1a (GSD1a, von Gierke) verhindert ein Defekt der Glucose-6-Phosphatase, dass die Leber Glucose aus der Gluconeogenese oder Glycogenolyse freisetzen kann, die Glucose bleibt als Glucose-6-phosphat in der Zelle gefangen. Schwere Hypoglykämien sind die Folge. Schwere Unterzuckerungen resultieren auch aus Defekten der Fructose-1,6-bisphosphatase und der Phosphoenolpyruvat-Carboxykinase 1 und 2, ebenfalls Schlüsselenzyme der Gluconeogenese. Die Defizienz des vierten Schrittmacherenzyms, der Pyruvat-Carboxylase, führt zu einer mangelnden Produktion von Oxalacetat. Aufgrund der vielfältigen Aufgaben von Oxalacetat kommt es hier zu komplexeren Störungsbildern.
Weblinks
[Bearbeiten]- KEGG: Glycolysis / Gluconeogenesis - Homo sapiens (human)
- The chemical logic behind... Gluconeogenesis von Prof. Doutor Pedro Silva
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.