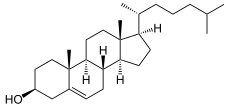
Biochemie und Pathobiochemie: Cholesterinbiosynthese
Allgemeines
[Bearbeiten]Cholesterin findet sich in Zellmembranen. Im Intermediärstoffwechsel ist es der Rohstoff für die Biosynthese von Steroidhormonen und Gallensäuren. Vom Cholesterin-Biosyntheseweg zweigen auch die Synthesewege von Ubichinon (Coenzym Q), Dolichol-Phosphat und Cholecalciferol (Vitamin D-Hormon) ab.
Biosynthese von „aktivem Isopren“ aus Acetyl-CoA
[Bearbeiten]| Tr. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| Acetyl-CoA | Acetyl-CoA | Acetyl-CoA C-Acetyltransferase Mitochondrium | 2.3.1.9 | Tr | α-Methylaceto- acetacidurie | ||||||
|
|||||||||||
| + SRE-1 | H2O, Acetyl-CoA | HMG-CoA-Synthase Mitochondrium | 2.3.3.10 | Tr | HMGCS2-Def. | ||||||
|
|||||||||||
| + SRE-1 | 2 NADPH/H+ | HMG-CoA-Reduktase Zytosol | 1.1.1.34 | Ox | |||||||
|
|||||||||||
| ATP
ADP |
Mevalonat-Kinase
Peroxisom |
2.7.1.36 | Tr | Hyper-IgD-S., Mevalon- acidurie | |||||||
|
|||||||||||
| ATP
ADP |
Phosphomevalonatkinase Peroxisom | 2.7.4.2 | Tr | ||||||||
|
|||||||||||
| ATP
ADP |
Pyrophosphomevalonat- Decarboxylase Peroxisom | 4.1.1.33 | Ly | ||||||||
|
|||||||||||
|
|
|||||||||||
|
|||||||||||
| FMN / FAD; Mg / Mn / Ca | 3-Isopentenyl- pyrophosphat-Isomerase | 5.3.3.2 | Iso | ||||||||
|
|||||||||||
Der erste Schritt, die Bildung von Acetoacetyl-CoA aus 2 Acetyl-CoA entspricht der Umkehrung des letzten Schritts der β-Oxidation.
Terpenoid-Biosynthese
[Bearbeiten]Terpenoid-Biosynthese durch Zusammenbau von 3 Isopreneinheiten zum Farnesylpyrophosphat. Kopf-Kopf-Kondensation von 2 Farnesylpyrophosphaten zum Squalen:
| Tr. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||
| + SRE-1 | Isopentenyl-PP
PPi |
Dimethylallyl-transtransferase | 2.5.1.1 | Tr | |||||||
| + SRE-1 | Geranyltranstransferase | 2.5.1.10 | Tr | ||||||||
|
|||||||||||
| + SRE-1 | Isopentenyl-PP
PPi |
Dimethylallyl- transtransferase | 2.5.1.1 | Tr | |||||||
| + SRE-1 | Geranyltranstransferase | 2.5.1.10 | Tr | ||||||||
|
|||||||||||
|
|
Mg / Mn | Squalen-Synthase | 2.5.1.21 | Tr | |||||||
|
|||||||||||
| 2 NADPH/H+
PPi, 2 NADP+ |
|||||||||||
|
|||||||||||
Ringschluß und Modifikation der Ringe und Seitenketten
[Bearbeiten]Ringschluß von Squalen zum Viererring-System und Modifikation der Ringe und Seitenkette zum Cholesterin:
| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| AH2, O2
A, H2O |
FAD | Squalen-Monooxygenase | 1.14.99.7 | Ox | ||||||
|
||||||||||
| Lanosterol-Synthase | 5.4.99.7 | Iso | ||||||||
|
||||||||||
| 3 O2, 3 NADPH/H+ | Häm-Thiolat | Sterol-14-Demethylase | 1.14.13.70 | Ox | ||||||
|
||||||||||
| NADPH/H+ | δ-14-Sterol-Reduktase | 1.3.1.70 | Ox | HEM-Skelett- dyplasie | ||||||
|
||||||||||
| 3 O2, 3 NADPH/H+
4 H2O, 3 NADP+ |
Methylsterol- Monooxygenase | 1.14.13.72 | Ox | |||||||
|
||||||||||
| NADP+ | Sterol-4-α-carboxylat- 3-Dehydrogenase (decarboxylierend) | 1.1.1.170 | Ox | CHILD-Syndrom | ||||||
|
||||||||||
| NADPH/H+ | 3-Keto-Steroid-Reduktase | 1.1.1.270 | Ox | |||||||
|
||||||||||
| ? [H]
? [CH3] |
multi-step reaction | |||||||||
|
||||||||||
| Cholestenol-δ-Isomerase * | 5.3.3.5 | Iso | Conradi-Hunermann-Happle-S. | |||||||
|
||||||||||
| NADPH/H+ | NADPH/H+ | δ-24-Sterol-Reduktase * | 1.3.1.- | Ox | Desmosterolosis | |||||
|
||||||||||
| O2, NADH/H+
2 H2O, NADP+ |
Lathosterol-5-Desaturase | 1.14.21.6 | Ox | Lathosterolosis | ||||||
|
||||||||||
| NADH/H+ | 7-Dehydrocholesterol- Reduktase | 1.3.1.21 | Ox | Smith-Lemli-Opitz-S. (SLOS) | ||||||
|
||||||||||
 |
* Umgekehrte Reihenfolge möglich. Zwischenprodukt ist dann nicht 5α-Cholesta-7,24-dien-3β-ol, sondern Zymostenol.
Squalen wird zuerst in das reaktionsfreudige Squalen-Epoxid umgewandelt. Danach erfolgt der Zusammenschluß der 4 Ringe, die das Steroid-Gerüst bilden. Vom entstandenen Lanosterol bis zum fertigen Cholesterinmolekül folgen nun diverse Modifikationen:
- Sukzessive Beseitigung von 3 Methylgruppen (zwei in Position 4 und eine in Position 14)
- Verlagerung der Doppelbindung von Position 8 nach Position 5 über mehrere Zwischenschritte
- Auflösung der Doppelbindung in der Seitenkette
Das Steran-(Gonan-)Ringgerüst ist aus vier homozyklischen Kohlenstoffringen zusammengesetzt und besteht aus 17 C-Atomen. Mit der Seitenkette sind es 26 C-Atome.
Stoff- und Energiebilanz
[Bearbeiten]Zur Synthese eines Cholesterinmoleküls werden sechs HMG-CoA bzw. 18 Acetyl-CoA benötigt. Außerdem kostet die Synthese eine Menge Energie, nämlich 25 Reduktionsäquivalente (überwiegend NADPH/H+) und 18 ATP.
Für die Bildung eines Cholesterin-Moleküls müssen daher netto ca. 10 bis 11 Glucose-Moleküle abgebaut werden: 9 für die Bildung von 18 Acetyl-CoA (dabei werden bereits die benötigten 18 ATP gebildet) und mind. 2 Glucose-Moleküle für die NADPH/H+-Produktion im HMP-Weg (alternativ kann NADPH/H+ im Citrat-Malat-Pyruvat-Zyklus aus NADH/H+ erzeugt werden). Etwas positiver wird die Bilanz, wenn man noch die 18 NADH/H+ (entspr. 45 ATP oder dem vollständigen Abbau von 1,4 Glucose-Molekülen) gegenrechnet, die bei der dehydrierenden Decarboxylierung der 9 Glucose-Moleküle gewonnen werden.
Biologische Bedeutung
[Bearbeiten]Cholesterin wird in Zellmembranen eingebaut und ist der Rohstoff für die Biosynthese der Steroidhormone wie Aldosteron, Cortisol und Sexualsteroide. Das Cholesterinvorläufermolekül 7-Dehydrocholesterol dient auch der Biosynthese von Vitamin D-Hormon. Im Blut wird Cholesterin v.a. als Cholesterinester in low density lipoproteins (LDL) transportiert. LDL transportiert Cholesterin vorwiegend von der Leber in die Peripherie, während high density lipoproteins (HDL) Cholesterin in die Gegenrichtung transportieren.
Regulation
[Bearbeiten]Die Cholesterinsynthese erfolgt bedarfsorientiert und in Abhängigkeit vom Angebot in der Nahrung, reguliert durch das Sterolregulationselement 1 (SRE-1). Daraus ergibt sich, dass sich der Cholesterinspiegel über diätetische Maßnahmen nur gering beeinflussen lässt. Die Elimination erfolgt durch die Umwandlung in Gallensäuren.
Verbindungen zu anderen Stoffwechselwegen
[Bearbeiten]- Die Bildung von β-Hydroxy-β-methylglutaryl-CoA (HMG-CoA) bildet auch den Start der Ketonkörperbiosynthese.
- Vom Farnesylpyrophosphat zweigt die Biosynthese von Dolicholphosphat und Coenzym Q ab.
- Aus 7-Dehydrocholesterol wird Vitamin-D-Hormon gebildet.
- Cholesterin selbst ist der Ausgangspunkt für die Biosynthese der Steroidhormone und Gallensäuren.
Pathobiochemie
[Bearbeiten]Ein hohes LDL in Kombination mit einem niedrigen HDL fördert die Atherosklerose der Gefäße. Ein genetischer Defekt des LDL-Rezeptors führt zum Krankheitsbild der familiären Hypercholesterinämie (OMIM), bei der es frühzeitig zu einer schweren Atherosklerose kommt.
Pathologie
[Bearbeiten]Histologisch finden sich in Atheroskleroseplaques neben lipidbeladenen Makrophagen (Schaumzellen) häufig typische spaltförmige Cholesterin-Lücken (cholesterol clefts, cholesterol imprints), die dadurch entstehen, dass die Cholesterinkristalle bei der Vorbehandlung ausgewaschen werden.
Pharmakologie
[Bearbeiten]Die HMG-CoA-Reduktase ist das pharmakologische Target der Statine (CSE-Hemmer), die bei Hypercholesterinämie und zur Progressionsverzögerung der Atherosklerose eingesetzt werden. Von der Cholesterin-Synthese zweigt auch auf Höhe des Zymosterols die Ergosterol-Synthese der Pilze ab. Daher können mit Cholesterinsynthese-Hemmstoffen, die vor dieser Abzweigung ansetzen, auch Pilzinfektionen behandelt werden. Beispiele für derartige Antimykotika sind Amorolfin, Naftifin und Terbinafin, die die Squalen-Monooxygenase (EC 1.14.99.7) hemmen und Azol-Antimykotika wie z.B. Clotrimazol, die die Sterol-14-Demethylase (EC 1.14.13.70) inhibieren.
Weblinks
[Bearbeiten]
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.