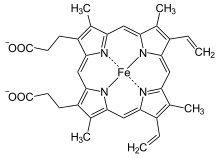
Biochemie und Pathobiochemie: Porphyrinbiosynthese
Allgemeines
[Bearbeiten]Die farbigen Häm-Moleküle dienen im Blut in Form des Hämoglobins als Sauerstofftransportmittel, im Muskel als Sauerstoffspeicher. Häm dient weiterhin vielen Enzymen, die Redoxreaktionen und Elektronentransfers ermöglichen, als prosthetische Gruppe.
Biosynthese eines Häm aus 8 Succinyl-CoA und 8 Glycin
[Bearbeiten]| Tr. | Tl. | Lok. | All. | ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC/EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||
| - Häm | - Häm (HRE) | - Häm | Pyrid- oxal- phos- phat | δ-Aminolävulinat- Synthase 1 (δ-ALA-S1) Lebermitochondrien | 2.3.1.37 Tr | ||||||||
| + EPO | - Fe- Mangel (IRP1) | - Häm (HRE) | δ-Aminolävulinat- Synthase 2 (δ-ALA-S2) Knochenmitochondrien | Sideroblastische Anämie (XLSA) | |||||||||
|
|||||||||||||
|
|
spontan | ||||||||||||
|
|||||||||||||
|
|
Zn | Porphobilinogen- Synthase (δ-ALA- Dehydratase)
Zytosol |
4.2.1.24 Ly | δ-ALA- Dehydratase- Mangel (ADM), Akute hepatische Porphyrie | |||||||||
|
|||||||||||||
| H2O
|
Dipyrro- methan | PBG-Deaminase
Zytosol |
2.5.1.61 Tr | Akute intermittierende Porphyrie (AIP) | |||||||||
|
|||||||||||||
|
|
Uroporphyrinogen-III- Synthase (Isomerase)
Zytosol |
4.2.1.75 Ly | Kongenitale erythropoetische Porphyrie (KEP) | ||||||||||
|
|||||||||||||
|
|
Uroporphyrinogen- Decarboxylase
Zytosol |
4.1.1.37 Ly | Porphyria cutanea tarda (PCT), Hepatoerythro- poetische Porphyrie (HPP) | ||||||||||
|
|||||||||||||
| O2
2 H2O, 2 CO2 |
Koproporphyrinogen- Oxidase
Mitochondrium |
1.3.3.3 Ox | Hereditäre Koproporphyrie (HKP) | ||||||||||
|
|||||||||||||
|
|
FAD | Protoporphyrinogen- Oxidase
Mitochondrium |
1.3.3.4 Ox | Porphyria variegata (PV) | |||||||||
|
|||||||||||||
| + EPO | Fe2+
2 H |
Ferrochelatase
Mitochondrium |
4.99.1.1 Ly | Protoporphyrie (PP) | |||||||||
|
|||||||||||||
Die Biosynthese von Häm aus Succinyl-CoA und Glycin umfasst acht enzymatisch katalysierte Schritte und verteilt sich auf zwei zelluläre Kompartimente: Zytosol und Mitochondrium. Die Regulation erfolgt hauptsächlich auf Höhe der δ-Aminolävulinat-Synthase.
Eigenschaften und biologische Bedeutung
[Bearbeiten]Porphyrine (πορφυρά, porphyrá (griech.): Purpurfarbstoff) bestehen aus vier Pyrrol-Ringen, die durch vier Methin-Gruppen kreisförmig verbunden sind. Die Farbigkeit vieler Porphyrine geht auf die konjugierten Doppelbindungen und aromatischen Eigenschaften zurück. Neben dem intensiv roten Häm, das dem Blut seine Farbe gibt, gehört z.B. auch das grüne Chlorophyll der Pflanzen dazu. Für die Funktion ist die Komplexierung eines Metallions im Ringsystem essentiell. Beim Häm ist dies Eisen, beim Chlorophyll Magnesium. Die fünfte Koordinationsstelle des Häm-Eisens wird vom Stickstoff einer Histidin-Seitenkette des Hämoglobins besetzt. Vom Biosyntheseweg der Porpyrine zweigt auch der Bildungsweg der verwandten Cobalamine (Vitamin B12) ab. Diese werden nur von Mikroorganismen gebildet und bestehen aus einem Corrin-Ringsystem, das zentral ein Kobaltion komplexiert. Gemeinsam ist allen, dass sie vier verbundene Pyrrole (ein Pyrrol ist ein aromatischer 5-Ring aus vier Kohlenstoff und einem Stickstoff) enthalten und damit ein Tetrapyrrol bilden.
Die Häm-Synthese findet in allen Körperzellen statt, da Häm für die Atmungskette benötigt wird, eine besonders hohe Syntheserate findet sich jedoch in den erythropoetischen Vorläuferzellen im Knochenmark (Hämoglobin-Bildung) sowie in der Leber (Biotransformation Phase I).
Das zentrale Eisenion im Häm kann leicht Elektronen aufnehmen und abgeben, d.h. zum Fe3+ oxidiert und zum Fe2+ reduziert werden. Daher werden Hämmoleküle v.a. bei Oxidoreduktasereaktionen eingesetzt, z.B. bei der Entgiftung (Disproportionierung) von Wasserstoffperoxid (H2O2) zu Sauerstoff (O2) und Wasser (H2O) (Katalase (Häm b)), im Rahmen der hepatischen Biotransformation Phase I (Cytochrom P450 Oxidase (Häm b)), in der Cyclooxygenase-Reaktion der Prostaglandinbiosynthese, (Cyclooxygenase (Häm b)) und in der mitochondrialen Elektronentransportkette (Succinatdehydrogenase (Häm b), Cytochrom c Reduktase (2x Häm b, Häm c), Cytochrom c Oxidase (2x Häm a) und Cytochrom c Peroxidase (Häm b)). Der Häm-Fe2+-Komplex kann an der sechsten freien Koordinationsstelle auch leicht reversibel molekularen Sauerstoff binden und wird daher als Sauerstofftransportmittel (Hämoglobin (Häm b)) und -speicher (Myoglobin (Häm b)) verwendet.
Der Transkription des ersten (δ-ALA 2 der Erythroblasten) und des letzten Häm-Biosyntheseenzyms wird von Erythropoetin (EPO) induziert. Das Glycoprotein-Hormon wird bei peripherem Sauerstoffmangel (z.B. bei Anämie, chronischen Lungenerkrankungen, Herzinsuffizienz, Höhenaufenthalte) von der Niere freigesetzt und stimuliert nicht nur die Hämbiosynthese, sondern auch die Reifung der roten Vorläuferzellen.
Weiterhin wird die Hämbiosynthese an das verfügbare Eisen und das bereits vorhandene Häm angepasst, hier spielen das Eisen-sensorische und das Häm-regulatorische Element ein Rolle.
In der Leber wird Häm sowohl für die Cytochrome der Atmungskette benötigt als auch als Cytochrom P450 für die Biotransformation. Die Startreaktion der Hämbiosynthese wird in den Leberzellen zusätzlich transkriptionell und allosterisch durch Häm gehemmt, so dass die Synthese streng nach Bedarf aktiviert wird.
Pathobiochemie
[Bearbeiten]Enzymdefekte führen zum Krankheitsspektrum der Porphyrien.
Pharmakologie
[Bearbeiten]Bei renaler Anämie (Niereninsuffizienz) muss Erythropoetin (EPO), das normalerweise von der Niere gebildet wird, substituiert werden. EPO wird auch als Dopingmittel missbraucht, um den Hb und damit die Sauerstofftransportkapazität des Blutes zu erhöhen.
Toxikologie
[Bearbeiten]Blei ersetzt das Zinkion im aktiven Zentrum der Porphobilinogensynthase (δ-ALA-Dehydratase), die dadurch funktionsuntüchtig wird. Auch die Funktion der Koproporphyrinogen-Oxidase wird beeinträchtigt. In der Folge kommt es zum Anstau von δ-Aminolävulinat und zur Anämie. Auch der Coproporphyrinogen III-Spiegel ist erhöht. Blei führt weiterhin zur Neuropathie (z.B. N. radialis-Lähmung). Blei wird vor allem im Knochen abgelagert. Bleiexposition in der Schwangerschaft führt zur mentalen Retardierung.
Kohlenmonoxid (CO) bindet mit einer 200- bis 300-fach höheren Affinität an das Häm im Hämoglobin als Sauerstoff und kann daher bereits bei niedriger Luftkonzentration zu hohen CO-Hb-Spiegeln führen, die am Sauerstofftransport nicht mehr teilnehmen können. Die CO-Bindung führt außerdem zu einer Linksverschiebung der Sauerstoffbindungskurve, so dass im peripheren Gewebe auch die Sauerstoffabgabe des verbliebenen Oxy-Hämoglobins erschwert wird. Es kommt rasch zum inneren Ersticken. CO entsteht bei unvollständiger Verbrennung und wird besonders beim Betrieb von Heizungen und Öfen in schlecht gelüfteten Räumen zur Gefahr.
Cyanide (-C≡N) wie z.B. Blausäure (HCN) oder Zyankali (KCN) hemmen die Cytochrom c Oxidase (Komplex IV) der Atmungskette und führen dadurch zur inneren Erstickung.
Wird das Fe2+ im Hämoglobin zum Fe3+ oxidiert, so entsteht das braune Methämoglobin (MetHb, Hämiglobin). Dieses kann Sauerstoff zwar noch gut binden, aber peripher nur noch schwer abgeben. Eine Methämoglobinämie kann so zum inneren Ersticken führen, obwohl die pulsoxymetrisch messbare Sauerstoffsättigung völlig normal ist. Methämoglobin entsteht physiologisch durch Autooxidation, was durch die Methämoglobinreduktase ständig rückgängig gemacht wird. Die normale MetHb-Konzentration liegt unter 1 %. Eine Methämoglobinämie kann hervorgerufen werden durch 1) Vergiftungen mit Oxidationsmitteln (Chlorate), Nitrite, Amylnitrit, Nitroglyzerin, aromatische Amino- und Nitroverbindungen (Anilin, Nitrobenzol), 2) Enzymdefekte (Methämoglobin-Reduktase-Defizienz, Glucose-6-Phosphat-Dehydrogenase-Mangel) und genetische Störungen des Hämoglobins (Hämoglobin M) und 3) durch manche Arzneimittel bes. bei den vorgenannten Erkrankungen. Hierzu gehören Lokalanästhetika (Benzocain, Lidocain, Procain), Malariamittel (Primaquin), Sulfonamide und Paracetamol sowie Phenazopyridin.
Weblinks
[Bearbeiten]
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.