Biochemie und Pathobiochemie: Galactose-Stoffwechsel
Allgemeines
[Bearbeiten]Lactose (Milchzucker) bzw. Galactose (Schleimzucker) ist für alle Säugetiere (Mammalia) eine wichtige Energiequelle in der Neugeborenen- und Säuglingsperiode. Galactose wird zudem für den Aufbau der Glycane benötigt, die sich z.B. im Bereich der Schleimhäute finden. Ein Lactasemangel ist eine häufige Ursache für die Unverträglichkeit von Milch- und Milchprodukten im Erwachsenenalter. Enzymdefekte des Galactoseabbaus führen zur Galactosämie.
Abbau von Lactose bzw. Galactose zu Glucose (Leloir pathway)
[Bearbeiten]| ⇓ | Subst. | ( ⇑ ) | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
| H2O
α-D-Glucose |
β-Galactosidase | 3.2.1.23 | Hyd | GM1-Gangliosidose, Mucopolysaccharidose IVb (Morquio B) | ||||||
| Lactase | 3.2.1.108 | Lactose-Intoleranz | ||||||||
| ATP
ADP |
Galactokinase | 2.7.1.6 | Tr | Galaktosämie II | ||||||
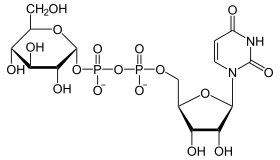
| UDP-Glucose | UDP-Glucose | Galactose-1-phosphat-Uridylyltransferase | 2.7.7.12 | Tr | Galactosämie | |||||
|
||||||||||
| NAD | UDP-Glucose-4-Epimerase | 5.1.3.2 | Iso | Galactosämie III | ||||||
|
||||||||||
Lactose (Milchzucker) ist ein reduzierender Doppelzucker bei dem die zwei Monosaccharide β-glycosidisch miteinander verbunden sind. Lactose wird im Darm von Lactase (β-Galactosidase) hydrolytisch in die Einzelzucker Glucose (Traubenzucker) und Galactose (Schleimzucker) gespalten.
Die Galactose kann dann in drei Schritten (Leloir pathway) zu UDP-Glucose umgewandelt werden:
- Galactose wird von der Galactokinase zu Galactose-1-phosphat phosphoryliert.
- Dieses kann wiederum von der Galactose-1-phosphat-Uridylyltransferase katalysiert ein UMP von UDP-Glucose übernehmen, wobei Glucose-1-phosphat frei wird.
- Die nun aktivierte UDP-Galactose kann dann von der UDP-Glucose-4-Epimerase zu UDP-Glucose epimerisiert werden (Galactose unterscheidet sich von Glucose letztlich nur in der Stellung der Hydroxylgruppe am C4-Atom).
Biosynthese von Lactose aus Glucose
[Bearbeiten]| ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||
| NAD | UDP-Glucose-4-Epimerase | 5.1.3.2 | Iso | Galactosämie III | ||||||
|
||||||||||
| α-D-Glucose
UDP |
Lactose-Synthase | 2.4.1.22 | Tr | |||||||
Die Lactosebiosynthese in der lactierenden Brustdrüse wird von einem Enzymkomplex aus β-1,4-Galactosyltransferase (beta4Gal-T1) mit α-Lactalbumin katalysiert. Hierbei wird UDP-Galactose unter Abspaltung von UDP über eine β-1,4-glycosidische Bindung mit Glucose zur Lactose verbunden(s.o.).
UDP-Galactose wird zudem für die Biosynthese verschiedener Glycane, z.B. Chondroitinsulfat verwendet, das reichlich im Bereich der Schleimhäute zu finden ist, daher die deutsche Bezeichnung „Schleimzucker“ für Galactose.
Umwandlungen von Glucose, Glucose-phosphat und UDP-Glucose
[Bearbeiten]| Tr. | All. | ⇓ | Subst. | ⇑ | Co. | Enzym | EC | EG | Erkr. | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| - G6P | ATP
ADP |
1. |
Pi
H2O |
1) Hexokinase | 2.7.1.1 | Tr | Hexokinase I-Defizienz | |||||
| + Insulin | - GKRP | 1) Glucokinase (HK IV) | 2.7.1.2 | MODY2, PNDM, HHF3 | ||||||||
| + cAMP
- Insulin |
2) Glucose-6- Phosphatase | 3.1.3.9 | Hyd | GSD 1a (von Gierke) | ||||||||
| Phosphoglucomutase | 5.4.2.2 | Iso | GSD14, CDG1T | |||||||||
| UTP
PPi |
1. |
UMP
H2O |
1) UTP-Glucose-1-phosphat- Uridylyltransferase | 2.7.7.9 | Tr | |||||||
| 2) Nucleotid- Diphosphatase | 3.6.1.9 | Hyd | ||||||||||
|
||||||||||||
Hier sind noch einmal die Umwandlungsmöglichkeiten von der Glucose bis zur UDP-Glucose in beide Richtungen abgebildet. Die Hexokinase gehört zur Glycolyse, die Glucose-6-Phosphatase zur Gluconeogenese. Die Bildung des aktivierten Zuckers steht auch am Anfang der Biosynthese von Glycogen und Glucuronsäure.
Pathobiochemie
[Bearbeiten]Abhängig von Ethnie und Lebensalter ist die Lactase-Aktivität im Darm mitunter nicht ausreichend um die Lactose von Milchprodukten vollständig zu spalten. Lactose wird nicht resorbiert und führt einerseits zum osmotischen Wassereinstrom, andererseits kann es zur bakteriellen Zersetzung im Dickdarm kommen. Typische Folgen des Lactase-Mangels (Milchzuckerunverträglichkeit) sind gastrointestinale Beschwerden wie Blähungen und Durchfall.
In Asien und Afrika sind mehr als 90 % der Erwachsenen betroffen, Kaukasier zu 5 bis 15 %. Mit dem Alter nimmt die Lactase-Aktivität natürlicherweise ab, da Milch in der Tierwelt nur der Säuglingsernährung dient.
Ein Lactase-Mangel kann allerdings auch primär vorhanden sein bedingt durch einen Gendefekt. Auch chronische Magen-Darm-Erkrankungen können die Lactoseverwertung beeinträchtigen.
Als Behandlungsansatz bietet sich je nach Restkapazität eine Lactosearme oder -freie Diät an. Auch orale Enzymersatzpräparate sind erhältlich.
Alle drei Enzyme des Leloir pathway können defizient sein und zum Krankheitsbild der Galactosämie führen. Eine Defizienz der Galactose-1-phosphat-Uridylyltransferase (GALT) ist die häufigste Ursache der Galactosämie („klassische Galactosämie“). Die Häufigkeit beträgt etwa 1:47.000 Geburten. Die Erkrankung wird mit einer streng Galactose-freien Diät behandelt, nichtsdestotrotz können Spätfolgen wie kognitive oder ovarielle Störungen auftreten. Ursache ist wohl die endogene Galactosebiosynthese aus anderen Zuckern.
Literatur
[Bearbeiten]- Fridovich-Keil JL. “Galactosemia: the good, the bad, and the unknown”. J. Cell. Physiol., 209:701–5, December 2006. DOI:10.1002/jcp.20820. PMID 17001680.
- Holden HM, Rayment I, Thoden JB. “Structure and function of enzymes of the Leloir pathway for galactose metabolism”. J. Biol. Chem., 278:43885–8, November 2003. DOI:10.1074/jbc.R300025200. PMID 12923184.
- Frey PA. “The Leloir pathway: a mechanistic imperative for three enzymes to change the stereochemical configuration of a single carbon in galactose”. FASEB J., 10:461–70, March 1996. PMID 8647345.
Weblinks
[Bearbeiten]- KEGG: Galactose metabolism - Homo sapiens (human)
- KEGG: Glycolysis / Gluconeogenesis - Homo sapiens (human)
| Allgemeine Hintergrundfarbe für Substrate | Hintergrundfarbe Reaktionspfeile | „Schlüsselenzyme“ | |
| Energiereiche Phosphate Reduktionsäquivalente | CO2 / HCO3− C1-Reste Stickstoff |
Abk.: Tr.: Transkriptionelle Regulation, Tl.: Regulation der Translation, Lok.: Regulation über die Enzymlokalisation, Kov.: Regulation durch kovalente Modifikation, All.: Allosterische Regulation, Koop.: Kooperativer Effekt, Co.: Cofaktoren, EC: Enzymklassifikation, EG: Enzymgruppe (Oxidoreductase, Transferase, Hydrolase, Lyase, Isomerase, Ligase), Erkr.: Assoziierte Erkrankungen.
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.