Pathologie: Ösophagus
Buch-Navigation
Angeborene und erworbene Fehlbildungen
[Bearbeiten]Ösophagusatresie
[Bearbeiten]Def.: Angeborener Verschluss oder Fehlen eines Stücks des Ösophagus, oft kombiniert mit einer oberen oder unteren Ösophagotrachealfistel.
Pg.: Embryonale Fehlentwicklung in der Frühschwangerschaft.
Einteilung nach VOGT:
| Typ | Pathologie |
|---|---|
| I | Ösophagusaplasie, d.h. der Ösophagus fehlt (keine Luftansammlung im Magen). |
| II | Ösophagusatresie ohne ösophagotracheale Fistel (keine Luftansammlung im Magen). |
| IIIa | Atresie und ösophagotracheale Fistel zwischen oberem Ösophagussegment und Trachea, das untere Ösophagussegment endet blind. |
| IIIb | Atresie und ösophagotracheale Fistel zwischen unterem Ösophagussegment und Trachea, das obere Ösophagussegment endet blind. Häufigste Form. |
| IIIc | Atresie mit ösophagotrachealer Fistel am unteren und oberen Ösophagussegment. |
| IV | Ösophagotracheale Fistel ohne Atresie (sog. H-Fistel). |
Klinik: Polyhydramnion, Husten bei den ersten Trinkversuchen, Speichelfluss.
Kompl.: Aspirationspneumonie, Exsikkose, Entgleisung von Elektrolyt- und Säure-Basen-Haushalt.
 |
Achalasie
[Bearbeiten]Ät.: Innervationsstörung des Ösophagus
Klinik: Kardiospasmus, Megaösophagus
Ösophagusvarizen
[Bearbeiten]Ät.: Pfortaderhochdruck z.B. bei Leberzirrhose mit Expansion der Umgehungskreisläufe. (weitere Manifestationen: Caput medusae, Hämorrhoiden)
Kompl.: Lebensbedrohliche Blutung
Divertikel
[Bearbeiten]Aussackungen der Organwand
Pulsionsdivertikel oder „Pseudodivertikel“ bestehen nur aus der Mucosa und Submucosa und entstehen durch Druck von Innen, der die Schleimhat durch Schwachstellen der Muskulatur drückt. Vorkommen: Oberer Ösophagus (ZENKER-Divertikel, mit 70 % das häufigste) und am gastroösophagealen Übergang (10 %). Außerhalb der Speiseröhre z.B. im Colon als Colon-Divertikel.
Traktionsdivertikel oder „echte Divertikel“ bestehen aus allen Wandschichten und entstehen durch (Narben-)Zug von außen. Vorkommen: Mittlerer Ösophagus in Höhe der Bifurkation, z.B. bei vernarbender Mediastinaltuberkulose.
MALLORY-WEISS-Läsion
[Bearbeiten]Längliche Schleimhauteinrisse am ösophagokardialen Übergang.
Ät.: Drucksteigerungen (Erbrechen, Husten, Pressen), Alkoholexzesse
Kompl.: Lebensbedrohliche Blutungen
Boerhaave-Syndrom
[Bearbeiten]Maximalform der Mallory-Weiss-Läsion mit spontaner submuköser Zerreißung des Ösophagus, meist supradiaphragmal links-dorsal.
Ät.: Heftiges Erbrechen, meist bei Alkoholikern
Klinik: Plötzliches retrosternales Vernichtungsgefühl, Hämatemesis, Schock, Tachy- und Dyspnoe, Abwehrspannung im Oberbauch, Pneumothorax, zervikofaziales Hautemphysem, Mediastinalemphysem, evtl. subphrenische Luftsicheln.
Prg.: Letalität zwischen 20 und 40 %.
Ösophagitis
[Bearbeiten]Infektiöse Ösophagitis
[Bearbeiten]Ep.: Infektiöse Ösophagitis fast nur bei Immundefizienz (marantische Patienten, Tumorkranke, Immunsuppression nach Transplantation).
Virale Ösophagitis
[Bearbeiten]Ät.: HSV, CMV.
Makro: Multiple Ulzera, in allen Ösophagusabschnitten möglich.
Histo: Viruseinschlußkörperchen, Milchglaskerne, Entzündung, Erosion/Ulzeration.
Erreger und Klinik:
- HSV - Dysphagie, eher schmerzhaft
- CMV - Geringere Beschwerden
 |
 |
 |
Soor-Ösophagitis
[Bearbeiten]Infektion der Ösophagusschleimhaut durch Candida albicans. Zumeist bei Immunkompromittierten (Intensivpatienten, AIDS, Tumorpatienten, Patienten mit Endokrinopathien insbes. Diabetes mellitus), selten auch bei ansonsten gesunden Menschen.
Makro: Weiße, abwischbare/abziehbare Beläge.
Histo: Nachweis von Pseudohyphen (PAS-Färbung).
DD.: Eosinophile Ösophagitis.
 |
Eosinophile Ösophagitis
[Bearbeiten]Ät.: Allergisch-immunpathologisch.
Makro: Weiße Beläge, oft auch unauffällige Schleimhaut.
Histo: Eosinophile Infiltration.
D.: Biopsie im mittleren Ösophagusdrittel.
DD:
- Terminale Wundheilungphase z.B. bei Reflux, daher Biopsie im distalen Ösophagus nicht aussagekräftig.
- Infektionen mit z.B. Pilzen.
Klinik: Typische Allergikeranamnese, Dysphagie.
 |
 |
 |
 |
Gastroösophageale Refluxkrankheit (GERD)
[Bearbeiten]Syn.: Refluxösophagitis
Ät.: Störung der ösophagealen Clearance (reduzierte Motilität, reduzierter Speichelfluss, Achalasie), Hyperazidität, Hypotonie des unteres Ösophagussphinkters, axiale Gleithernie, Mageninnendruckerhöhung, Magenentleerungsstörungen, Schwangerschaft, Rauchen, Alkohol.
Makro: Rötung, Ödem, Erosionen. Klinische Schweregrad-Einteilung nach SAVARY und MILLER vier Krankheitsstadien:
- I - Einzelne Erosionen (= Epitheldefekte).
- II - Longitudinal konfluierende Erosionen.
- III - Zirkulär konfluierende Erosionen, die die gesamte Zirkumferenz des Ösophagus einnehmen.
- IV - Komplikationen: Ulkus (die Läsion erreicht tiefere Wandschichten), Barrett-Ösophagus, Strikturen (Narbenstränge), Stenose (narbige Lumeneinengung).
Histo:
- Basalzellhyperplasie: Basalzellschicht > 15 % der Epitheldicke.
- Verlängerte Papillen reichen bis in das oberste Epitheldrittel.
- Interstitielles Ödem mit erweiterten Interzellularspalten.
Klinik: Asymptomatisch oder Sodbrennen, saures Aufstoßen, Dysphagie, evtl. Laryngitis (Heiserkeit), Bronchitis, Asthma, Zahnschäden.
Kompl.: Obere GI-Blutung (chron. Eisenmangelanämie), Narben, Strikturen, BARRETT-Ösophagus, Adenokarzinom.
Plattenepithelpapillom
[Bearbeiten]Ät.: HPV-assoziiert.
Histo: Polypoide fingerförmig verzeigte Läsionen, bestehend aus vaskularisiertem Bindegewebe und überkleidet von unauffälligem „benignem“ Plattenepithel.
Verh.: Benigne.
 |
 |
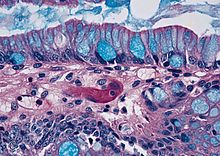
BARRETT-Ösophagus
[Bearbeiten]BARRETT's mucosa
Syn.: BARRETT-Mucosa, BARRETT-Schleimhaut
Def.: Intestinale Zylinderepithelmetaplasie im distalen Ösophagus, d.h. das Plattenepithel ist durch ein Zylinderepithel ersetzt.
Embryologie Ösophagusschleimhaut:
- Ab 3. Monat - Zylinderepithel
- Ab 4. Monat - Schleimbildendes Epithel
- Ab 6. Monat - Mehrreihiges Epithel
- Ab Geburt - Mehrschichtiges Plattenepithel, Reste von Zylinderepithel
Ep.: Zunehmende Inzidenz, w : m = 1 : 4,3
Lok.: Distaler Ösophagus
Ät.: Chronischer Reflux von Magensäure (, Galle)
Pathogenese: Vermutlich Differenzierungsänderung der lokalen Stammzellen (Metaplasie).
Makro: Rötliche lachsfarbene Läsionen die zirkulär oder zungenartig nach oral hin in die normale weißliche Ösophagusschleimhaut hineinreichen.
Histo der BARRETT-Schleimhaut:
- Flaches „schlampig gebautes“ Zylinderepithel.
- Meist inkomplette intestinale Metaplasie - In das Epithel eingelagerte Becherzellen und Prä-Becherzellen (Darstellung mit der Alcian-Färbung), selten komplett mit Bürstensaum und PANETH-Körnerzellen.
- Basal Reste irregulärer Cardia-Drüsen.
- Häufig doppelte Muscularis mucosae.
Formen:
- Ca. 15 % Long-segment-BARRETT-Ösophagus (> 30 mm)
- Ca. 80 % Short-segment-BARRETT-Ösophagus (< 30 mm)
- Ca. 5 % Ultrashort-segment-BARRETT-Ösophagus (nur mikroskopisch fassbar)
DD.:
- Intestinale Metaplasie der Kardia (CIM) - Höher aufgebaute Schleimhaut, komplette intestinale Metaplasie (In das Epithel eingelagerte Becherzellen, Bürstensaum, evtl. PANETH-Körnerzellen am Drüsengrund), angrenzend normale Kardia- oder Corpus-Schleimhaut.
- Ektope Magenschleimhaut
Kompl.: BARRETT-Ulkus, low-grade und high-grade intraepitheliale Neoplasie (früher: Dysplasie), BARRETT-Adenokarzinom (häufiger bei long-segment-BARRETT). Die BARRETT-Mucosa gilt somit als präkanzeröse Kondition.
 |
 |
 |
 |
 |
Geringgradige (low-grade) intraepitheliale Neoplasie (IN) der BARRETT-Mucosa
[Bearbeiten]Mikro:
- Weitgehend erhaltene Architektur der Krypten
- Becherzellverlust
- Weitgehend erhaltene Zellpolarität (basal gelegene Zellkerne)
- Verschiebung der Kern-Plasma-Relation zugunsten des Kerns mit Ausbildung stäbchenförmiger hyperchromatischer Zellkerne („Stäbchenepithel“).
- Fehlende Ausreifung nach luminal
- Abrupter Übergang vom dysplastischen zum normalen Epithel
DD Regeneratorisch veränderte BARRETT-Mucosa:
- Ausreifung nach luminal
- Fließender Übergang zwischen verändertem und normalen Epithel
 |
 |
 |
 |
Hochgradige (high-grade) intraepitheliale Neoplasie (IN) der BARRETT-Mucosa
[Bearbeiten]Mikro:
- Deutliche Störung der Kryptenarchitektur mit Ausbildung von Knospen und Verzweigungen („budding and branching“).
- Becherzellverlust
- Verlust der Zellpolarität (Zellkerne auch zentral und apikal)
- Verschiebung der Kern-Plasma-Relation zugunsten des Kerns mit Ausbildung hyperchromatischer pleomorpher Zellkerne.
- Prominente Nukleolen
- Mitosen häufiger und teilweise atypisch (z.B. tripolare Mitosen)
- Fehlende Ausreifung nach luminal
- Abrupter Übergang vom dysplastischen zum normalen Epithel
DD.: Invasives Adenokarzinom
 |
 |
 |
Ösophaguskarzinom
[Bearbeiten]Formen und RF:
- Plattenepithelkarzinom - RF: Malnutrition, Alkohol, Rauchen, Arbeiter
- Adenokarzinom inklusive BARRETT-Karzinom- RF: Adipositas, Reflux, Akademiker, BARRETT-Ösophagus
Lok.: Das Adenokarzinom findet sich meist distal (siehe BARRETT-Karzinom), Plattenepithelkarzinome häufiger an der mittleren und oberen Ösophagusenge.
Makro: „Rote Flecken“, Anfärbung mit Methylenblau.
Mikro: Atypien, hyperämische Gefäße, invasives Wachstum.
BARRETT-Karzinom
[Bearbeiten]Adenokarzinom im Bereich des distalen Ösophagus auf der Grundlage einer BARRETT-Schleimhaut.
Pg.: Vermutlich Reflux-induziert.
Mikro:
- High-grade intraepitheliale Neoplasie mit:
- Ausgeprägte Verzweigung der neoplastischen Drüsen mit Kalibersprüngen
- Dissoziation neoplastischer Zellgruppen
- Infiltratives Wachstum
- Einbrüche in das Blut- oder Lymphgefäßsystem
Literatur
[Bearbeiten]- Faller G et al. “Histopathologische Diagnostik der Barrett-Schleimhaut und ihrer Neoplasien - Ergebnisse einer Konsensus-Konferenz der Arbeitsgemeinschaft "Gastroenterologische Pathologie der Deutschen Gesellschaft für Pathologie" am 22. September 2001 in Erlangen”. Pathologe, 24(1):9-14, Feb 2003. PMID 12601473 -- Faller G et al. “Histopathological diagnosis of Barrett's mucosa and associated neoplasias: results of a consensus conference of the Working Group for Gastroenterological Pathology of the German Society for Pathology on 22 September 2001 in Erlangen”. Virchows Arch., 443(5):597-601, Nov Epub 2003 Sep 24 2003. PMID 14508684
Buch-Navigation
