Pathologie: Magen
Buch-Navigation
Fehlbildungen und Entwicklungsstörungen
[Bearbeiten]Gastroschisis
[Bearbeiten]Angeborener Bauchdeckendefekt mit Vorfall der Eingeweide.
Durch den Kontakt mit Fruchtwasser ist die Darmwand reaktiv verdickt -> Motilitätseinschränkung -> Nach operativer Versorgung erhöhtes Ileusrisiko.
Enterothorax
[Bearbeiten]Angeborene Hiatushernie mit Verlagerung von Magen und/oder Darmanteilen in den Thorax.
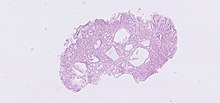
Hypertrophe Pylorustenose
[Bearbeiten]Makro: Der Pylorus ist verdickt und spastisch verengt.
Klinik: Ab ca. der 3. Lebenswoche auftretendes schwallartiges Erbrechen, Exsikkose, Entgleisung von Energie-, Elektrolyt- und Säure-Basen-Haushalt (hypochlorämische Alkalose).
Medikamente
[Bearbeiten]Protonenpumpeninhibitoren (PPI)
[Bearbeiten]Eingesetzt z.B. bei Gastritis, Magenulkus, Magenblutung.
Histo:
- Drüsenkörperzysten (s.u.)
- Antrale G-Zell-Hyperplasie
- Pseudohypertrophie von Belegzellen
 |
 |
 |
Hiatushernie
[Bearbeiten]Vergrößerte Zwerchfelllücke (Hiatus ösophagei) mit Verlagerung von Bauchinhalt in den Thorax.
Formen:
- Axiale Gleithernie - Verlagerung der Kardia -> Kompl.: Refluxösophagitis.
- Paraösophageale Hernie - Verlagerung des Fundus -> Kompl.: Passagehindernis, Inkarzeration, Erosionen/Ulkus.
- Upside-Down-Stomach - Der Magen ist komplett in den Thorax verlagert.
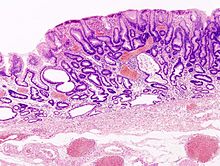
Gastropathien
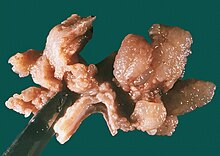
[Bearbeiten]MÉNÉTRIER-Syndrom
[Bearbeiten]Syn.: Gastropathia hypertrophica gigantea, Riesenfaltengastritis
HIsto: Hyperplasie des schleimbildenden Oberflächenepithels (foveoläre Hyperplasie), Atrophie der Haupt- und Belegzellen.
Kompl.: Maligne Entartung.
 |
 |
Gastritis
[Bearbeiten]Entzündung der Magenschleimhaut. Korrelation mit der klinischen Diagnose Dyspepsie (Sodbrennen, Oberbauchbeschwerden, saures Aufstoßen, Völlegefühl) sehr variabel. Die chronische Gastritis ist oft asymptomatisch.
Klassifikation des Gastritiden nach:
- Ätiologie:
- Typ A - autoimmun (perniziöse Anämie)
- Typ B - bakteriell (meist H. pylori)
- Typ C - chemisch-toxisch (NSAR, Gallenreflux)
- Sonstige: Lymphozytäre, eosinophile, granulomatöse Gastritis, Strahlengastritis, GVHD u.a.
- Verlauf:
- akut
- chronisch (einschl. Zusatzbefunde wie Atrophie, intestinale Metaplasie)
- akut (floride) und chronisch
- Topographische Verteilung:
- Antrumgastritis
- Corpusgastritis
- Kardiagastritis
- Schweregrad jeweils der akuten (floriden) und chronischen Komponenten
Akute Gastritis
[Bearbeiten]Akute Magenschleimhautentzündung.
Akute hämorrhagische/erosive Gastritis
[Bearbeiten]Ät.: Stress (Intensivpatienten), Hypoperfusion (Schock), Fremdstoffe (ASS, Diclofenac, Kortikosteroide, Alkohol, Rauchen, Zytostatika), Urämie, Helicobacter pylori u.a.m.
Mikro: Ödem (aufgelockertes Stroma), Kongestion (erweiterte blutreiche Kapillaren), Einblutungen, regenerative Epithelveränderungen, kaum Entzündungszellen, evtl. Anschnitte von Erosionen (fibrinbelegte Epitheldefekte, Granulozyten).
Kompl.: Obere GI-Blutung
Akute H. pylori-Gastritis
[Bearbeiten]Syn.: Typ B-Gastritis
Ep.: Selten, da akute H.p.-Infektion meist oligosymptomatisch oder inapparent.
Mikro: Epitheldegeneration, oberflächliche neutrophile Infiltration.
Phlegmonöse Gastritis
[Bearbeiten]
Ät.: Z.B. im Rahmen einer Sepsis
Bildgebung: In der Computertomographie findet sich eine diffuse, hypodense Verbreiterung der Magenwand mit unscharfer Verdichtung des umgebenden Fettgewebes als Zeichen einer Mitreaktion.
Mikro: Submuköse Eiteransammlungen (massenhaft teils zerfallende neutrophile Granulozyten)
Chronische Gastritis
[Bearbeiten]Morphologisch, topographisch und ätiopathogenetisch lassen sich verschiedene Formen der chronischen Gastritis unterscheiden, die sich auch überlappen können. Hauptverursacher chronischer Gastritiden ist Helicobacter pylori.
Chronisch atrophe Gastritis Typ (A-Gastritis)
[Bearbeiten]Ep.: 40 - 50 Lj., w:m = 10:1
Ät.: Häufig Autoimmungastritis (Auto-Ak gegen Belegzellen und/oder intrinsic factor). Autoimmun-Diagnose nur im klinischen Kontext möglich.
Lok.: Korpus-prädominant.
Mikro:
- Atrophie der Corpus-Drüsen (Belegzellschwund)
- Metaplasie (intestinale oder antrale Metaplasie)
- Corpus-betonte Entzündung
- Im Antrum G-Zell-Hyperplasie, im Corpus ECL-Hyperplasie (Enterochromaffin-like cells).
Klinik: Evtl. Druckgefühl im Oberbauch, Belegzellenschwund -> Achlorhydrie, Intrinsic-factor-Mangel -> Vitamin-B12-Malabsorption -> perniziöse Anämie (Morbus BIERMER).
Kompl.:
- Karzinomrisiko erhöht.
- HCl-Mangel -> Stimulation von gastrinproduzierenden G-Zellen im Antrum -> Gastrin stimuliert auch ECL im Corpus -> Endokrine Tumoren (Gastrinome, Karzinoide), nicht-autonom und mit guter Prognose.
 |
 |
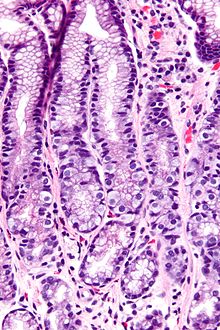
Multifokal-atrophische Gastritis
[Bearbeiten]Syn.: Typ B-Gastritis
Ät.: Helicobacter pylori, andere Faktoren.
Lok.: Pangastritis (Antrum + Corpus) mit multifokal auftretenden atrophisch-metaplastischen Bezirken.
PP.: Chronischer Entzündungsreiz durch bakterielle Enzyme (Urease), Zytotoxine, Adhäsine.
Mikro.: Ausgeprägte chronisch-aktive Entzündung häufig mit Lymphfollikel-Bildung, Immunzellen durchdringen die Mucosa, leichter Belegzellschwund -> Hypochlorhydrie, Nachweis von H. pylori auf den Epitheloberflächen (kurze gebogene bis spiralige Stäbchenbakterien), DD Helicobacter heilmanii (länger, korkenzieherartig und weniger wandadhärend), fokale Atrophien und intestinale oder pseudopylorische Metaplasie mit Schwerpunkt im antrocorporalen Übergang.
Das beschriebene Bild ist suggestiv für eine H. pylori-assoziierte Gastritis. Bei fehlendem H. pylori-Nachweis: sampling error aufgrund der variablen und teilweise fleckförmigen Helicobacter-Verteilung (klinischerseits weitere Tests sinnvoll, z.B. Serologie, Stuhl- oder Atemtest) oder DD Morbus Crohn!
Kompl.: Ulkus, MALT-Lymphom, Magenkarzinom.
Nicht-atrophische Gastritis
[Bearbeiten]Syn.: Typ B-Gastritis
Ät.: Helicobacter pylori, häufigste Form.
Lok.: Diffuses, meist Antrum-prädominantes Muster der Entzündung.
Histo:
- Wie oben, aber ohne Atrophie oder Metaplasie.
- Chronische Komponente: Infiltration durch Lymphozyten und Plasamzellen, evtl. eosinophile Granulozyten.
- Aktive (floride) Komponente: Intraepitheliale neutrophile Granulozyten.
- Für beide Komponenten ist eine Schweregradeinteilung üblich (meist dreistufig)
- H.p.-Nachweis (versch. Methoden/Färbungen möglich)
SF/IHC: H.p. ist im H&E-Schnitt schlecht zu erkennen, daher werden meist Sonderfärbungen (Giemsa, Warthin-Starry) oder seltener die Immunhistochemie bemüht.
Kompl.: MALT-Lymphom, Ulkus, obere GI-Blutung.
Prg.: Benigner als die multifokal-atrophische Gastritis, geringeres Entartungsrisiko.
Chemisch-toxische Gastritis
[Bearbeiten]Syn.: Typ C-Gastritis, reaktive Gastritis, reaktive Gastropathie
Ät.: Chemisch-toxisch (Gallereflux, NSAR, Kortikoide, Hyperkalziämie).
Mikro: Foveoläre Hyperplasie, reaktive Epithelveränderungen (geringe Kernvergrößerung und Kernhyperchromasie mit leichten Kerngrößenschwankungen), Ödem, Proliferation der glatten Muskelzellen, nur wenig Entzündungszellen.
 |
 |
 |
Strahlengastritis
[Bearbeiten]Ät.: Ionisierende Strahlung
Lymphozytäre Gastritis
[Bearbeiten]Ät.: Unklar. Assoziiert mit der Zöliakie.
Lok.: Corpus-prädominant
Makro: Endoskopisch häufig varioliformes Muster (noduläre Erosionen entlang der Magenfalten).
Mikro: Lymphozytäre Infiltration des Oberflächenepithels überwiegend durch CD8+-Zellen. Intraepitheliale Lymphozyten (IEL) > 25 pro 100 Epithelzellen.
 |
Infektiöse Gastritis (andere als H.p.)
[Bearbeiten]Ät.: Viren (Enteroviren, CMV), Bakterien (Helicobacter heilmanii), Pilze (Candida sp., Histoplasma capsulatum, Mucormykosen), Parasiten (Strongyloides stercoralis, Anisakis).
Granulomatöse Gastritis
[Bearbeiten]Ät.: Morbus CROHN, Sarkoidose, Fremdkörper, Infektionen (Tbc, Histoplasma capsulatum, Anisakis sp.), Vaskulitis-assoziiert, idiopathisch.
Histo: Epitheloidzellgranulome.
 |
Eosinophile Gastritis
[Bearbeiten]Ät.: Allergisch
Mikro: Viele eosinophile Granulozyten, kaum andere Entzündungszellen.
Klinik: Assoziation mit atopisch-allergischen Erkrankungen und Bluteosinophilie.
DD: Lokale Eosinophilie bei Parasitose, Morbus CROHN, Karzinom, Ulkus u.a.m.
Kollagene Gastritis
[Bearbeiten]Ep.: selten
Mikro: Subepitheliale Kollagendeposition.
GvHD-Gastritis
[Bearbeiten]Ät.: Graft versus host disease nach allogener Knochenmark- oder Stammzelltransplantation.
Vaskuläre Gastropathie
[Bearbeiten]Portal-hypertensive Gastropathie
[Bearbeiten]Ät.: Pfortaderhochdruck z.B. bei Leberzirrhose
Mikro: Ggf. ist eine Dilatation und Schlängelung der venösen Gefäße erkennbar.
Antrale Gefäßektasie
[Bearbeiten]Makro: Endoskopisch longitudinale Streifen geröteter Schleimhaut („Wassermelonen-Magen“).
Mikro: Dilatierte Kapillaren mit Fibrinthromben.
 |
 |
 |
Befundung
[Bearbeiten]Biopsiematerial: Mind. 2x Antrum, 2x Corpus, evtl. 1x Incisura ventriculi (wird dem Antrum zugerechnet), zusätzlich Biopsate ggf. auffälliger Läsionen (Ulzera, Rötungen u.a.).
Erforderliche klinische Angaben:
- Klinischer Befund und Verdachtsdiagnose
- Endoskopischer Befund
- Medikation der letzten Monate (COX-Hemmer, PPI, Antazida, Antibiotika, Chemotherapie u.a.)
- Relevante Vordiagnosen (Makrozytäre Anämie, Z.n. H.p.-Eradikationstherapie, Z.n. Bestrahlung, Intensivtherapie, Immunsuppression, HIV-Infektion, Tbc, Z.n. allogener Stammzelltransplantation u.a.m.)
Färbungen: H&E, Helicobacter-Färbung (z.B. modifizierte Giemsa, Warthin-Starry, IHC), evtl. Sonderfärbung zur Kontrastierung einer intestinalen Metaplasie (Alcian-Blau, PAS).
Beurteilung: Die Beurteilung berücksichtigt folgende Parameter jeweils für Antrum und Corpus, die anhand einer visuellen Analogskala graduiert werden können:
- H. pylori -> B-Gastritis
- Neutrophile -> Akute Gastritis
- Lymphozyten und Plasmazellen -> Chronische Gastritis
- Atrophie -> Chronische Gastritis, Präneoplasie
- Intestinale Metaplasie -> Chronische Gastritis, Präneoplasie
- Zusatzbefunde, z.B.: Foveoläre Hyperplasie, Lymphfollikel, starke Lymphozyteninfiltration (V.a. MALT-Lymphom?), Eosinophilie, Hyperplasie endokriner Zellen, Granulome (Morbus CROHN?), Erreger u.a.m.
Diagnose: Abhängig von der Befundkonstellation und den klinischen Angaben. Bsp.: Helicobacter pylori-positive chronisch-aktive Antrum-prädominante Gastritis. Oder: Corpus-betonte chronisch-atrophe Gastritis, H.p.-negativ, evtl. autoimmun-vermittelt.
Literatur:
- Dixon MF et al. “Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994.”. Am J Surg Pathol, 20(10):1161-81, Oct 1996. PMID 8827022
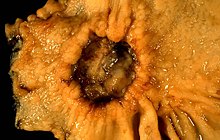
Magenulkus
[Bearbeiten]Ät.: Ungleichgewicht zwischen protektiven und aggressiven Faktoren.
- Protektiv: Schleim, Bicarbonatsekretion, Durchblutung.
- Aggressiv: Heliobacter pylori, Hyperazidität, Hyperkalzämie, Schleimhautschäden (Kortikoide, NSAR), Stress (Intensivpatienten, Operationen, Infekte u.a.), erhöhter Vagotonus, Rauchen u.a.m.
Mikro: Defekt mit Fehlen der Mucosa und Eindringen in tiefere Schichten. Wundgrund mit Fibrin, Entzündungszellen und Granulation.
Makro: Oft ausgestanzter Defekt mit Fibrinbelägen, kaum Randwall. DD.: Magenkarzinom!
Kompl.:
- Perforation - Klinik: akutes Abdomen.
- Obere GI-Blutung - Klinik: Schwäche, Blässe, Schock, Übelkeit, Bluterbrechen oder Kaffeesatzerbrechen, evtl. Teerstuhl oder Hämatochezie bei massiver Blutung.
 |
 |
 |
Metaplasie
[Bearbeiten]Intestinale Metaplasie
[Bearbeiten]Ersatz von Magenschleimhaut durch intestinal differenziertes Epithel.
Formen:
- Komplette intestinale Metaplasie - Becherzellen (Alcian-Blau pos. (saure Muzine) und PAS pos. (neutrale Muzine)), Dünndarmtypische resorbierende Zellen mit Mikrovillisaum, evtl. PANETH-Körnerzellen.
- Inkomplette intestinale Metaplasie - Colonschleimhautartig, Becherzellen, keine Mikrovilli, keine PANETH-Körnerzellen.
Bedeutung: Zeichen der chronischen Gastritis. Erhöhtes Entartungsrisiko (bei unvollständiger eher als bei kompletter Metaplasie).
Anmerkung: Helicobacter pylori findet sich i.d.R. nicht auf intestinalisierter Schleimhaut. Umgekehrt kann Helicobacter außerhalb des Magens vorkommen z.B. auf ektoper Magenschleimhaut im Ösophagus oder auf Inseln gastrischer Metaplasie im Duodenum.
 |
 |
 |
 |
Intestinale Metaplasie der Kardia (CIM)
[Bearbeiten]Ep.: w:m = 1,1:1
Histo:
- (Meist komplette) intestinale Metaplasie (s.o.)
- Seitlich foveoläres Magenepithel
- basal Kardia- und/oder Fundusdrüsen
DD.: BARRET-Ösophagus
Pylorus-Typ Metaplasie im Corpus
[Bearbeiten]Histo: Ersatz der Corpusdrüsen durch Pylorusdrüsen
Vork.:
- chronisch-atrophe Gastritis
- Anastomosenregion nach Magenteilresektion
Magenpolypen
[Bearbeiten]Benigne Wucherungen der Magenschleimhaut.
Typen:
- Nicht-neoplastisch:
- Hyperplastischer Magenpolyp (80 - 90 %) - Hyperplastisches Foveolen mit langen Drüsenschläuchen, entzündliche Infiltrate aus Lymphozyten, Plasmazellen und Eosinophilen.
- Juveniler Magenpolyp (selten) - Vermehrtes ödematöses Stroma, dilatiertes Drüsen, Entzündung, Erosionen.
- Fundusdrüsenpolyp / ELSTER'sche Drüsenkörperzysten - Zystisch dilatierte Drüsen, mit oder ohne polypoide Vorwölbung der Schleimhaut. Ät.: Assoziation mit FAP, Therapie mit Protonenpumpenhemmern (hypertrophe vakuolisierte knopfartig vorspringende Belegzellen durch erhöhte Gastrin-Sekretion).
- PEUTZ-JEGHERS-Polyp - s.u. PEUTZ-JEGHERS-Syndrom (PJS)
- Neoplastisch:
- Adenomatöser Magenpolyp (10 - 20 %) - Tubuläre, villöse oder tubulovillöse Epithelwucherungen; entarten eher.
Benigne Magentumoren
[Bearbeiten]Gastrisches Xanthelasma
[Bearbeiten]Makro: Gelbliche Schleimhauterhebung.
Histo: Schaumzellaggregate.
IHC: CD68.
Verh.: Benigne. Nicht-neoplastisch.
 |
 |
 |
 |
Schwannom
[Bearbeiten]Histo: Spindelzelliger Tumor.
IHC: S-100 +.
DD.: GIST, Leiomyom.
Leiomyom
[Bearbeiten]Histo: Spindelzelliger Tumor.
IHC: alpha-Actin +.
DD.: GIST, Schwannom.
Magenkarzinom
[Bearbeiten]RF.:
- Chronische B-Gastritis (Helicobacter pylori), v.a. wenn vom multifokal-atrophischen Typ, Hauptursache
- Chronisch-atrophische Gastritis (Typ A), Achlorhydrie
- MÉNÉTRIER-Syndrom = Gastropathia hypertrophica gigantea (Riesenfaltengastritis)
- Adenomatöse Polypen
- Zustand nach Magenresektion
- Alkohol, Nitrosamine, Aflatoxine, Ernährungsgewohnheiten
- Familiäre Häufung
Pg.: Wichtigste Sequenz: H. pylori-Besiedelung -> Chronische Gastritis -> intestinale Metaplasie -> intraepitheliale Neoplasie (=Dysplasie) -> Adenokarzinom vom intestinalen Typ.
Klassifikation der Magenkarzinome nach LAUREN:
- Intestinaler Typ (50 %) - Glanduläre Strukturen
- Diffuser Typ (40 %) - Alle anderen Typen
Klinik: B-Symptome, Oberbauchbeschwerden, Abneigung gegen Fleisch, Akanthosis nigricans maligna.
Th.: Operation, Chemotherapie, Trastuzumab beim met. Magenkarzinom bei Her2/neu-Überexpression und/oder -amplifikation (IHC 3+ oder IHC2+/FISH+).
Literatur:
- Genta RM et al. “Assessing risks for gastric cancer: new tools for pathologists”. World J Gastroenterol., 12(35):5622-7, Sep 21 2006. PMID 17007013
- Correa P. “Human gastric carcinogenesis: a multistep and multifactorial process--First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention”. Cancer Res., 52(24):6735-40, Dec 15 1992. PMID 1458460
- Rüschoff J, Nagelmeier I, Baretton G, et al.. “[Her2 testing in gastric cancer. What is different in comparison to breast cancer?]”. Pathologe, 31:208–17, May 2010. DOI:10.1007/s00292-010-1278-1. PMID 20443098.
Magenfrühkarzinom
[Bearbeiten]Mikro: Tumorinfiltration auf Mucosa und Submucosa begrenzt, Lamina muscularis propria tumorfrei, kein CIS (Carcinoma in situ)! Lymphknoten können bereits positiv sein.
Histologische Formen:
- Siegelzelltyp
- Intestinaltyp
Endoskopische Klassifikation:
- Typ I - Auf die Mucosa beschränkt, polypös, exophytisch, seltenste Form.
- Typ II - Auf die Mucosa beschränkt.
- Typ IIa - Leicht erhaben.
- Typ IIb - Schleimhautniveau, irreguläre Oberfläche.
- Typ IIc - Leicht abgesenkt, häufigste Form.
- Typ III - Submucosa infiltriert, exkaviert mit zentralem Ulkus, Ca v.a. im Randbereich aktiv.
Th.: Bis Stadium IIc endoskopisch-ablative Entfernung gut machbar, bei III nur in Ausnahmefällen (Inoperabilität u.a.).
Prg.: 5-Jahres-Überlebensrate 75 - 90 %
Magenkarzinom
[Bearbeiten]Makro: Ulkus-ähnlicher Defekt, Randwall. Grauweiße Schnittfläche.
Histologische Typen:
- Adenokarzinom
- Papillär
- Tubulär
- Muzinös (schleimbildend)
- Adenosquamös
- Siegelringzellkarzinom (große, rundliche Zellen mit randständigem Kern. Das schaumige Zytoplasma färbt sich in der PAS-Färbung rot.)
- Gallertkarzinom (extrem schleimbildend)
- Plattenepithelkarzinom
- Szirrhös (undifferenziert mit Bindegewebe)
Tumorregressionsgrading nach neoadjuvanter Vortherapie (nach Becker et al., 2003):
| Grad | Beschreibung |
|---|---|
| 1a | Kein Residualtumor im Tumorbett |
| 1b | < 10% Residualtumor im Tumorbett |
| 2 | 10–50% Residualtumor im Tumorbett |
| 3 | > 50% Residualtumor im Tumorbett |
Literatur:
- Becker K, Mueller JD, Schulmacher C, et al.. “Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy”. Cancer, 98:1521–30, October 2003. DOI:10.1002/cncr.11660. PMID 14508841.
Gastrointestinaler Stromatumor (GIST)
[Bearbeiten]Ep.: Selten, Altersgipfel 60. - 70. Lj.
Ursprung: vermutlich Verwandschaft mit den CAJAL-Schrittmacherzellen des GIT.
Pg.: Mutationen des c-kit-Protoonkogens (CD117), seltener des PDGFA-Rezeptors.
Lok.: Magen > Dünndarm > Kolorektum >> Mesenterium > Ösophagus
Makro: submukös gelegen, umschrieben bis rund, grauweiße solide und gelegentlich zystische Schnittfläche.
Mikro: spindelzellig, epitheloid oder gemischt.
IHC: CD117 (c-Kit) +, DOG1 +, CD34 + (spindelzellig), alpha-Actin -, Desmin -.
Prg.fakt.: Lokalisation, Größe, mitotische Aktivität.
Risikostratifizierung:
- nach Fletcher (2002):
| Risiko | Größe | Mitosen pro 50 HPF |
|---|---|---|
| Sehr niedrig | < 2 cm | < 5 |
| Niedrig | 2-5 cm | < 5 |
| mittel | < 5 cm | 6-10 |
| 5-10 cm | < 5 | |
| hoch | > 5 cm | > 5 |
| > 10 cm | Jede Mitosezahl | |
| Jede Grösse | > 10 |
- nach Miettinen (2006):
| Risiko | Größe | Mitosen pro 50 HPF | |||
|---|---|---|---|---|---|
| Magen | Duodenum | Jejunun/Ileum | Rektum | ||
| Kein Risiko | Kein Risiko | Kein Risiko | Kein Risiko | </= 2 cm | </= 5 |
| Sehr niedrig | Niedrig | Niedrig | Niedrig | > 2 - </= 5 cm | |
| Niedrig | Hoch | Intermediär | Hoch | > 5 - </= 10 cm | |
| Intermediär | Hoch | Hoch | Hoch | > 10 cm | |
| Kein Risiko | (keine Daten) | Hoch | Hoch | </= 2 cm | > 5 |
| Intermediär | Hoch | Hoch | Hoch | > 2 - </= 5 cm | |
| Hoch | Hoch | Hoch | Hoch | > 5 - </= 10 cm | |
| Hoch | Hoch | Hoch | Hoch | > 10 cm | |
Alternativ: Risikostratifizierung nach Miettinen und Lasota (2006).
Th.: Resektion, Tyrosinkinasehemmer (Imatinbib), Multikinasehemmer (Sunitinib). Schlechtes Ansprechen auf Chemo- oder Strahlentherapie.
DD.: Schwannom (S-100 +), Leiomyom (alpha-Actin +).
 |
 |
 |
 |
 |
Benigne mesenchymale Tumoren
[Bearbeiten]Klinik: Magenblutung
Buch-Navigation