Pathologie: Degenerative ZNS-Erkrankungen
Buch-Navigation
Altersassoziierte Veränderungen
[Bearbeiten]Corpora amylacea
[Bearbeiten]Ep.: Sehr häufig, mit zunehmendem Alter fast immer zu beobachten.
Ät.: Unklar.
Lok.: Vorwiegend subpial und subependymal, aber auch verstreut im übrigen ZNS. Seltener in der Lunge zu finden, häufig in den Prostatadrüsen.
Histo: Mehr oder weniger basophile meist runde bis ovale teils lamellär geschichtete Körperchen, teils mit kleinem zentralen Kern.
SF: PAS +, Kongo-Rot +.
Klinische Bedeutung: Gering.
 |
 |
Kalzifikationen
[Bearbeiten]Histo: Stark basophil (dunkelblau).
Psammom-Körperchen
[Bearbeiten]Lok.: Hauptsächlich im Plexus choroideus, gelegentlich im Arachnothel. Vorkommen auch z.B. in Plexuspapillomen, Meningeomen, papillären Schilddrüsenkarzinomen und serös-papillären Ovarialtumoren.
Klinische Bedeutung: Keine.
 |
Verkalkungen im Sulcus hippocampalis
[Bearbeiten]Ep.: Sehr häufig.
Histo: Stark basophile noduläre extrazelluläre Ablagerungen.
Klinische Bedeutung: Keine.
 |
 |
 |
FAHR-Syndrom
[Bearbeiten]Siehe im Kapitel Störungen der Blut- und Liquorzirkulation.
Granulovakuoläre Degeneration
[Bearbeiten]Gehäuft bei neurodegenerativen Erkrankungen wie Morbus ALZHEIMER.
Lok.: Hippocampus.
Histo: Intrazytoplasmatische Vakuolen jeilweils mit kleinem rundem basophilem Kern.
 |
HIRANO-bodies
[Bearbeiten]Gehäuft bei neurodegenerativen Erkrankungen wie Morbus ALZHEIMER.
Lok.: Hippocampus.
Histo: Intrazytoplasmatische kristalline homogen eosinophile und stäbchenförmige, ovale oder polygonale Einschlüsse.
 |
 |
 |
 |
Neurodegenerative Erkrankungen
[Bearbeiten]Definition: Progressiver Neuronenverlust bestimmter anatomischer Regionen des ZNS mit entsprechender klinischer Symptomatik. Trotz Möglichkeiten der Bildgebung sowie der Bestimmung von Biomarkern bleibt die postmortale Autopsiediagnostik der Goldstandard für die Diagnosesicherung.
Klinische Einteilung:
- Dementielle Erkrankungen
- Bewegungsstörungen (akinetisch-rigide, hyperkinetisch)
- Ataxien
- Motoneuronerkrankungen
Akkumulation abnormer Proteine intra- und extrazellulär ist für viele neurodegenerative Erkrankungen kennzeichnend und erlaubt daher in vielen Fällen eine akkurate Klassifikation. Nicht in allen Fällen ist das zugrundeliegende Gen auch mutiert. Die bekanntesten Einschlüsse sind die LEWY-Körperchen bei Morbus PARKINSON und die Amyloidplaques bei Morbus ALZHEIMER. Vor der Einführung der Immunhistochemie wurden viele Einschlüsse mit Versilberungstechniken (Bielschowski, Gallays) morphologisch sichtbar gemacht.
Histopathologische Einteilung:
- Prionenerkrankungen (sCJD, GSS, FFI)
- Amyloiderkrankungen (CAA, AD)
- Tauopathien (CBD, PSP, Pick, FTDP-17, AD)
- Synucleinopathien (PD, PDD, DLB)
- Umbiquitinopathien
- TDP-43-Proteinopathien (FTLD-TDP, ALS-TDP)
- FUSopathien (NIFID, ALS-FUS, FTLD-FUS)
Allgemeine Ursachen für die Entstehung neurodegenerativer Erkrankungen:
- oxidativer Stress (Bildung freier Radikale)
- Exitotoxizität (Exessive Stimulation von Neurotransmittern)
- Apoptose (Induktion des programmierten Zelltodes)
- Inflammation (Zytokin-Produktion)
- genetische Faktoren (Triplett-Expansionen, Suszeptibilitäts-Allele)
- altersbedingte Ineffizienz der Proteinabbau-Wege
Histologische Leitsymptome
- Spongiforme Auflockerungen: CJD, Hypoxie, FTLD
- Ballonierte Neurone: CBD, Metabolische Erkrankungen, kortikale Dysplasien, Pick
- Plaques: AD, CJD, Lafora-Disease
- Tangles: AD, PSP
- Oligodendroggliale Einschlüsse: MSA, PSP, CBD, AGD
- Astrozytäre Einschlüsse: PSP, CBD
- Neuronale Einschlüsse: PD, LBD, Pick, FTLD
- Körner: AGD
- Mineralablagerungen: NBIA, Morbus Fahr
- Astrogliose: HD, CJD, Metabolische Erkrankungen
Demenzen
[Bearbeiten]Morbus ALZHEIMER
[Bearbeiten]Alzheimer's disease (AD), senile dementia of the Alzheimer type (SDAT)
Geschichte: Erstbeschreibung der Tauopathie durch Alois Alzheimer (1907) an der Patienten Auguste Deter.
Ep.: Häufigste Form der Demenz (60 - 70 %) und häufigste degenerative ZNS-Erkrankung. Formen: 90 % Late-Onset, 10 % Early-Onset. Zunahme der Prävalenz mit dem Alter: 5 % der 70jährigen, 20 % der 80jährigen, 50 % der 90jährigen. Meist sporadisch, teils familiär („präseniler“ Alzheimer-Typ).
Ät.: Late-Onset Morbus ALZHEIMER:
- Variante von Apolipoprotein E: Das Allel Apo E ε4 erhöht das Risiko (Prävalenz Homozygoter: 2,8 %.).
- Defekte im Gen des neuronal sortilin-related receptor SORL1, der an der Verteilung des amyloid precursor protein (APP) beteiligt ist.
- Weiterer RF: Down-Syndrom.
Genetik: Autsomomal-dominant vererbte familiäre Formen mit frühem Erkrankungsbeginn mit Mutationen: beta-APP (Amyloid Precursor Protein), PSEN1, PSEN2 (Presenilin) bekannt, welche zu einer gesteigerten Aβ42-Produktion als Bestandteil seniler Plaques führt.
Pg.: Ablagerung von Amyloid-β-Peptid (Chr. 21), das aus dem Amyloid-β-Precursorproteins (APP) hervorgeht, wenn APP statt von α-Sekretasen (günstig) von β- und γ-Sekretasen (ungünstig) gespalten wird.
Makro: Diffuse, frontoparietal betonte kortikale Atrophie mit erweiterten Sulci und verschmälerten Gyri (Gewichtsverlust 14-40 % unter Altersnorm). Hydrozephalus ex vacuo. Verschmächtigter Bulbus olfactorius. Verschmächtigung des kortikalen Bandes.
Histo: Kardinalmerkmale: Senile Plaques (extrazelluläres Amyloid-β-Peptid) und neurofibrilläre Bündel (intraneuronale Tau-Aggregate) mit speziellem Verteilungsmuster.
- Senile Plaques: Anhäufung von Amyloid-β-Peptid (Nachweis mit Versilberung, Kongorot, Immunhistochemie). Verschiedene Formen:
- Neuritische Plaques: Enthalten einen Amyloid-Kern und in der Umgebung reaktiv veränderte neuronale Fortsätze. Darstellung mit Bielschowsky-Silberfärbung, Kongorot, Thioflavin oder beta-Amyloid-Immuno, in der HE nur schwach vom Neuropil abhebend. Tau positive dystrophe neuritische Fortsätze. Ansammlung länglicher Mikrogliazellen (CD11c +, CD68 +, CD163 +) mit radiärer Ausrichtung zu den Plaques.
- Diffuse Plaques: Nur mit Bielschowsky oder beta-Amyloid Immuno darstellbar, in der HE oder Kongorot nicht zu erkennen.
- Cotton wool plaques: Gut erkennbar in HE, meist in familiären Alzheimerformen.
- Kongophile Amyloidangiopathie (80 % der AD-Fälle): Hyalinisierte Gefäße, meist leptomeningeal und superfizielle Kapillaren. Immunhistochemisch überwiegend aus Aβ40.
- Alzheimerfibrillen (neurofibrillary tangles, NFT) - Intrazelluläre Aggregationen aus hyperphosphoryliertem τ-Protein (tau-Protein). In der HE schwach basophil und fibrillär. Nachweis auch mit Bielschowsky, Bodian, Gallyas-Silberfärbung oder Thioflavin-S möglich. In pyramidalen Neuronen meist flammenförmig. Bie Neuronenuntergang: Rückstände als sogenannte „ghost tangles“.
- „neuropil threads“: Tau-positive, argyrophile Zellfortsätze.
- Neuronenverlust (25-50 %)
- Hirano-Bodies (stäbchenförmige oder rundliche eosinophile Einschlüsse der hippocampalen Neuronen)
- Astrozytose (GFAP +)
- Granulovakuoläre Degenerationen
Topgraphisches Verteilungsmuster der Läsionen:
- Braak & Braak-Staging: I - VI: Dichte und betroffene Regionen der Tangles (I - II entorhinal, III - IV limbisch, V - VI kortikal).
- CERAD-Kriterien: 0,A-C: semiquantitative Bestimmung (spärlich, moderat, häufig) seniler Plaques frontal, temporal, parietal und Korrelation mit dem Alter des Patienten.
- NIA/Reagan-Konsensus-Kriterien: Kombination von CERAD und Braak: hohe (CERAD C, Braak V/VI), mittlere (CERAD B, Braak III/IV) und geringe (CERAD A, Braak I/II) Wahrscheinlichkeit für das Vorliegen von Morbus ALZHEIMER.
- Verteilung der Abeta-Amyloid-Plaques nach Thal et al.
PET: Amyloid-Plaques können in vivo mit Pittsburgh compound B (PiB), einem fluoreszierenden Analogon von Thioflavin T dargestellt werden.
Klinik: Überwiegend Störungen von Kognition (Kortex) und Gedächtnis (Hippocampus), später Persönlichkeitsstörungen. Aphasie, Apraxie, Orientierungsstörung, depressive Verstimmung.
DD:
- LEWY-body disease, tangle-only dementia.
Literatur:
- Hyman BT, Phelps CH, Beach TG, et al.. “National Institute on Aging-Alzheimer's Association guidelines for the neuropathologic assessment of Alzheimer's disease”. Alzheimers Dement, 8:1–13, January 2012. DOI:10.1016/j.jalz.2011.10.007. PMID 22265587.
- Thal DR, Rüb U, Orantes M, Braak H. “Phases of A beta-deposition in the human brain and its relevance for the development of AD”. Neurology, 58:1791–800, June 2002. PMID 12084879.
- Braak H, Braak E. “Neuropathological stageing of Alzheimer-related changes”. Acta Neuropathol., 82:239–59, 1991. PMID 1759558.
- Mirra SS, Heyman A, McKeel D, et al.. “The Consortium to Establish a Registry for Alzheimer's Disease (CERAD). Part II. Standardization of the neuropathologic assessment of Alzheimer's disease”. Neurology, 41:479–86, April 1991. PMID 2011243.
Weblinks:
Vaskuläre Demenz
[Bearbeiten]Formen:
- Mikroangiopathische Demenz, Subkortikale vaskuläre Enzephalopathie (SVE), Morbus BINSWANGER
- Demenz bei strategischem Einzelinfarkt
- Multiinfarktdemenz
- Demenz bei intra- oder extrazerebraler Blutung
- Kombinationen, Kombinationen mit nicht-vaskulären Formen
Mikroangiopathische Demenz
Syn.: Subkortikale vaskuläre Enzephalopathie (SVE), Morbus BINSWANGER
Ät.: Mikroangiopathie.
RF.: Arterielle Hypertonie, Diabetes mellitus, Rauchen.
Morph.: Mikroangiopathie, periventrikuläre Dichteminderung, multiple Lakunen.
Klinik: Kortikale Funktionen (Konzentration, Auffassungsgabe) etwas länger erhalten. Affekt und Antrieb früh betroffen. Fokal-neurologische Zeichen.
Prg.: Rasch progredient mit stufenweiser Verschlechterung.
SF.: Mischform mit Morbus Alzheimer, häufig.
Frontotemporale Demenzerkrankungen (FTLD)
[Bearbeiten]Ep: frontotemporale Demenzen machen ca. 10% aller dementiellen Erkrankungen aus.

Klinische Formen:
- Morbus Pick, Demenz vom Frontallappen-Typ (DFT) mit Verhaltensauffälligkeiten
- Semantische Demenz (SD)
- Primär-progressive nicht-flüssige Aphasie (PFNA), Mesulam-Syndrom
Histologische Einteilung:
- Frontotemporallappen-Demenzen mit TDP-43 (FTLD-TDP): 50%
- Frontotemporallappen-Demenzen mit FUS (FTLD-FUS, atypische FTLD-U, NIFID, BIBD)
- Frontotemporallappen-Demenzen mit Tau (FTDP-17, AGD, Pick, CBD, PSP)
- Frontotemporallappen-Demenzen des Ubiquitin-proteasom-System (FTLD-UPS)
FTLD-TDP
[Bearbeiten]
Ät: sporadisch oder familiär mit Mutationen in C9ORF72 (häufigste), TARDBP, VCP oder GRN), klinisches Überlappungsspektrum mit ALS
Klinik: Aphasie, Demenzen, Verhaltensstörungen, extrapyramidale Störungen, Motoneuronerkrankungen
Histo und Immuno: Ubiquitin + phosphorylisierte TDP-43 positive Einschlüsse im Marklager, frontotemporaler Cortex und Gyrus dentatus des Hippocampus. Kein Nachweis von FUS.
Neuropathologische Subtypen:
| Typ (Einteilung nach McKenzie) | Klinik | Mutation | Verteilungsmuster |
|---|---|---|---|
| Typ 1 | Aphasie, Verhaltensauffälligkeiten | GRN | neuronal zytoplasmatische Einschlüsse, kurze dystrophe Neuriten |
| Typ 2 | Semantische Demenz | TARDBP | Lange dystrophe Neuriten, wenige zytoplasmatische Einschlüsse |
| Typ 3 | Verhaltensauffälligkeiten, FTD mit ALS | C9ORF72 | kompakte, granuläre neuronal zytoplasmatische EInschlüsse, wenige Dystrophe Neuriten |
| Typ 4 | Einschlußkörperchenmyopathie, M. Paget, FTLD | VCP | zahlreiche neuronale intranukläre Einschlüsse, Dystrophe Neuriten , wenige zytoplasmatische Einschlüsse |
DD: Erkrankungen mit konkomitanter TDP-43 Pathologie: ALS-Parkinson-Demenz Komplex Guam, 20-60% der Alzheimer, LBD-Fälle
FTLD-FUS
[Bearbeiten]Ät: sporadisch, früherer Erkrankungsbeginn, meist Verhaltensauffälligkeiten
Histo: Frontallappenatrophie, Caudatumatrophie, Hippocampussklerose
Immuno: Ubiquitin und FUS-positive neuronal intranukläre Einschlüsse neokortikal, hippocampal, Striatum, Thalamus. Kein Nachweis von TDP-43.
Einteilung:
- atypische FTLD-U (TDP-43 negativ): filamentöse neuronale intranukläre FUS-Einschlüsse
- Neuronal intermediate filament inclusion disease (NFID): FUS- und alpha-Internexin positive, zytoplasmatische, neuronale Einschlüsse
- Basophilic inclusion body disease (BIBD): FUS-positive, zytoplasmatische, basophile Einschlüsse neuronal und glial, auch in ALS
Link: Datenbank der FUS-Mutationen
DD: Polyglutaminerkrankungen: Chorea Huntington, spinozerebelläre Ataxien: intranukläre Einschlüsse
FTDP-17
[Bearbeiten]
Frontotemporal dementia and parkinsonism linked to chromosome 17 (FTDP-17)
Ät: autosomal-dominant vererbte Mutationen im Tau-Gen (meist Exon 10 von MAPT) mit progressiver Akkumulation von hyperphosphorylisiertem Tau in Neuronen und Gliazellen.
Ep: Mehr als 100 Familien weltweit mit mehr als 38 verschiedenen Mutationen sind bekannt, Erkrankungsbeginn typischerweise im Erwachsenenalter (50 Lj.)
Klinik: Verhaltensauffälligkeiten, progressive Demenz, Parkinsonismus
Histo: Nachweis exzessiver Tau-Ablagerungen in Neuronen und Gliazellen. Tangle-ähnliche Einschlüsse wie bei AD lassen sich mit Silberfärbungen darstellen. Kein Nachweis TDP-43- oder alpha-Synuclein positiver Einschlüsse.
Link: Datenbank der bekannten MAPT-Mutationen
DD: andere Tauopathien: Morbus Pick, PSP, CBD, AGD
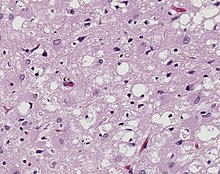
Morbus PICK
[Bearbeiten]Pick's disease
Ät: Tauopathie (3-repeat-Tau) aus dem Formenkreis der Frontotemporal-Lappen Demenzen (FTLD).
Ep.: Erstmanifestation 40. bis 50. Lj. (früher als Morbus Alzheimer), in 50 % familiäre Häufung.
Makro: Frontotemporale Hirnatrophie, „messerscharf“ abgegrenzt zu den normalen Hirnanteilen.
Mikro: Bodian-Silberfärbung: Ballonierte Zellen mit Pick-Körperchen im Gyrus dentatus des Hippocampus, zusätzlich kortikal und im Ncl. caudatus möglich. Agyrophile intraneuronale Einschlusskörperchen.
Immuno: Nachweis von Tau-Protein, Ubiquitin und Synaptophysin in Pick-Bodies. Zusätzlich TDP43-positive Einschlüsse.
Klinik: Störung von Antrieb, Impulskontrolle, Kritikfähigkeit.
DD: Alzheimer (alle 6 Tau-Isoformen in Tangles), andere FTLDs.
 |
Silberkornkrankheit (AGD)
[Bearbeiten]agryophilic grain disease, late-onset-dementia
Ep: Tauopathie (4-repeat Tau) mit Beginn um das 80. Lj. mit Verhaltensauffälligkeiten,ca. 4% aller Demenzen
Histo: Agryophilic grains bevorzugt im anteromedialen Temporallappen (Sektor CA1 Hippocampus, Presubiculum, hypothalamus), spindelige bis kommaartige coiled bodies um Oligodendroglia, selten ballonierte Zellen, beta-Amyloid-Plaques meist nur von der diffusen Form
 |
 |
LEWY-Körperchen-Demenz (LBD)
[Bearbeiten]Lewy-Body Dementia, Senile Demenz vom Lewy-Körperchen-Typ
LEWY-Körperchen (LK) können bei verschiedenen neuro-degenerativen Erkrankungen vorkommen:
- Lewy-Körperchen-Demenz
- Morbus ALZHEIMER mit LK
- Morbus PARKINSON
Ep: zweihäufigstes dementielles Syndrom (in bis zu 9% aller postmortalen Fälle)
Klinik: Peak um das 65 Lebensjahr, Assozitaion mit ApoE €4-Haplotyp. Progressive Demenz, Visuelle Halluzinationen, Fluktuierende Kognitivität, spontane Parkinson-Symptome, Gesteigerte Fallneigung, Synkopen, Wahnvorstellungen.
Mikro: Eosinophile, neuronal-intrazytoplasmatische Einschlusskörperchen (kortikale und klassische Lewy-Körperchen). Scoring von 5 verschiedenen häufig betroffenen Kortexarealen: Transentorhinaler Kortex, Gyrus cinguli, Gyrus frontalis, Gyrus temporalis und Lobus parietalis inferior. Scoring: 0 keine Einschlüsse, 1: bis zu 4 Lewy-Körperchen, 2: mehr als 4 Lewy-Körperchen. Die Summe bildet das Staging (McKeith): Hirnstamm-dominant (score 0-2), limbisch/transitional (score 3-6), neokortikal (score 7-10). Häufig konkomitante Alzheimer-Pathologie, meist jedoch diffuse Plaques, Neurofibrilläre Tanges hippocampal. Kortikale Mikrovakuolationen möglich.
Immuno: Alpha-Synuclein in Lewy-Körperchen, Lewy-Neuriten in Sektor CA2/3 des Hippocampus.
Andere Demenzen
[Bearbeiten]- Normaldruckhydrozephalus (NPH) durch erweiterte Ventrikel bei unauffälligem Liquor
- Chorea HUNTINGTON (s.u.)
- CJD (s.u.)
Akinetisch-rigide Störungen
[Bearbeiten]Parkinsonismus:
- idiopathischer Parkinson,
- familiärer (juveniler) Parkinson
- medikamenteninduzierter Parkinson (Neuroleptika)
- vaskulärer Parkinson (Binswanger)
- posttraumatischer Parkinson (Dementia pugilistica bei Boxern)
- toxischer Parkinson (MPTP, Kohlenmonoxid, Mangan)
- Atypische PARKINSON-Syndrome: MSA, PSP, CBD, LBD
In bis zu 10% der Fälle können postmortal einzelne Parkinson-typische Lewy-Körperchen im Hirnstamm beobachtet werden. Sie werden auch gelegentlich bei Morbus Pick, PSP und CBD beobachtet.
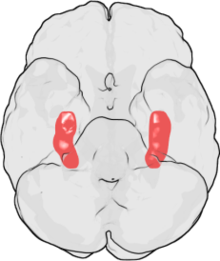
Morbus PARKINSON
[Bearbeiten]Parkinson's disease, Paralysis agitans
Ep.: Prävalenz 0,1 %, bei den über 65jährigen 1 %, bei den über 75jährigen 2 %. Mit 150-200/100.000 Fälle ist es die zweithäufigste neurodegenerative Erkrankung. Verwandte von Parkinson-Patienten haben ein 2-3fach erhöhtes Erkrankungsrisiko.
Ät.: Primär, „idiopathisch“, der Morbus PARKINSON (80 - 90 % der Parkinson-Syndrome). Ursache ist möglicherweise eine fehlgeleitete Signalkaskade, die die Nervenzellen in Richtung einer Zellteilung bewegt, obwohl ausdifferenzierten Nervenzellen eine Mitose nicht möglich ist. Es kommt zu Signalkonflikten und die Neurone gehen in die Apoptose. [1] Allerdings gibt es noch viele weitere Theorien zur Pathogenese, so dass die Frage noch nicht endgültig geklärt ist.
Genetik: Familiäre, juvenuile Formen mit autsosomal-dominanten und rezessiven Mutationen in Parkin, alpha-Synuclein und UCH-L1 bekannt.
Makro: Verlust der Pigmentierung der Substantia nigra im Mittelhirnschnitt. Geringgradige kortikale Atrophie.
Mikro: Depletion der melaninhaltigen dopaminergen Neurone in der Substantia nigra (bevorzugt ventrolateral), Intraneuronale, 8-30µm große Einschlüsse mit eosinophilem Kern und blassem Halo (klassische Lewy-Körperchen), welche auch multipel innerhalb eines Neurons auftreten können. Zur Ausschlussdiagnose sollten mindestens 4 unilaterale Schnitte der Substantia nigra mikroskopiert werden. Lewy-Körperchen finden sich auch im Locus coeruleus. Geringgradige Astrogliose möglich. Freies Neuromelanin (als Residuum eines untergegangenen Neurons) findet sich regelmäßig bei Parkinson, wird jedoch gelegentlich auch in altersentsprechenden Kontrollen beobachtet.
Immuno: Nachweis von alpha-Synuclein in Lewy-Körperchen (lassen sich auch für Ubiquitin, Synaptophysin und Chromogranin anfärben), Darstellung von a-Synuclein-positiven Lewy-Neuriten in der Amygdala, CA2-CA3 Sektor des Hippocampus sowie Hirnstammkernen.
Klinik: Rigor, Ruhetremor (distal betonter oft asymmetrischer Antagonistentremor, 5 Hz), Brady-/Hypo-/Akinese, Störung der posturalen Reflexe (Haltungskontrolle) mit Fallneigung nach vorne, Zahnradphänomen, typisches Gangbild mit kleinschrittigem Gang (erhöhte Wendeschrittzahl), autonome Störungen (Obstipation), Hypomimie, Freezing, monotone Sprache, Mikrographie, Rücken- und Schulterschmerzen. Parkinson mit Demenz (PDD) deutet auf eine kortikale Beteiligung hin.
DD.: Idiopathische Parkinson-Plus-Syndrome: Multisystematrophie (MSA), Corticobasale Degeneration (CBD), Lewy-Körperchen-Demenz (LBD), progressive supranukleäre Blickparese (PSP). Sekundäres (symptomatisches) Parkinson-Syndrom: Medikamentös (Neuroleptika), toxisch (MPTP), i.R.v. Morbus WILSON (hepatolentikuläre Degeneration), postenzephalitisch, traumatisch (Boxer).
Prognose: Unter L-DOPA Therapie ist die Lebenserwartung kaum reduziert. Die tiefe Hirnstimulation ermöglicht eine Verbesserung der Lebensqualität.
Multi-System-Atrophie (MSA)
[Bearbeiten]Ältere Bezeichnungen: Olivopontocerebelläre Atrophie (OPCA), striatonigrale Degeneration (SND), Idiopathische orthostatische Hypotonie (SHY-DRAGER-Syndrom)
Ät: sporadische Erkrankung mit Peak um das 53 Lebensjahr. Krankheitsdauer typischerweise 6-10 Jahre mit fatalem Verlauf.
Ep: 3-4/100.000, bzw. 2.2 MSA Fälle auf 100 Parkinsonfälle. Keine genetischen Ursachen bekannt.
Klinik: Asymmetrische PARKINSON-Symptome, cerebelläre Symptome, autonome Störungen (Erektile Dysfunktion, Inkontinenz) typischerweise zwischen 40-60. Lebensjahr, REM-Schlafstörungen, Stimm-Hypophonie.
Makro: Atrophie Kleinhirn, Pons, mittlere Kleinhirnschenkel. Abblassung der Substantia nigra und Locus coeruleus, Graubraune Verfärbung des atrophen Putamens
Histo: Nachweis einer abnorme Ansammlung des Proteins α-Synuclein in flammen- bis sichelförmigen Einschlusskörpern in der Oligodendroglia des Marklagers (Papp-Lantos-Einschlüsse) mit Gallays-Versilberungstechnik. Einteilung der Einschlüsse in a) neuronal-zytoplasmatisch, b) glial-zytoplasmatisch (am häufigsten), c) neuronal-nukleär, d) neuronal-zytoplasmatisch und e) Neuropilfäden (Pons, Putamen). Am ausgeprägtesten sind die Läsionen in der Substantia nigra, Putamen, den Oliven und Nucleus subthalamicus.
Einteilung: MSA-P (Parkinson: 80%), MSA-C (Cerebellär: 10%), Mischformen
Immuno: Nachweis von alpha-Synuclein oder Ubuqitin in den Einschlüssen.
DD: Morbus Parkinson, Spinozerebelläre Ataxien, CBD
Wikipedia: MSA
Progressive supranukleäre Blickparese (PSP)
[Bearbeiten]Syn.: STEELE-RIRCHARDSON-OLZEWSKI-Syndrom, Progressive supranuclear palsy
Ät: sporadische TAUOPATHIE mit Beteiligung multipler ZNS Strukturen: (H1-Haplotyp, Ablagerungsprodukt: four repeat Tau (wie auch CBD, AGD), d.h. mit Exon 10)
Klinik: Vertikale Blicklähmung, Gangunsicherheit, Sprachstörungen. Symmetrische Akinesie und Rigidität (Parkinsonismus), Fallneigung , supranuclear gaze palsy (Opthalmoplegie) Variabel: Dysarthrie, Dysphagie, Kognitive Beeinträchtigung bis zur Demenz Tod oft durch Aspirationspneumonien.
Epidemiologie: (65 Jahre; 50-77): 1.9-3.0/100.000, 61% Männlich, Alter ist derzeit einziger Risikofaktor. Zählt zur Gruppe der Parkinson plus Erkrankungen (zusammen mit MSA, CBD)
Makro: Hirngewicht nahezu normal. Depigmentierung der Substantia nigra & Locus coeruleus, Mittelhirn, Tegmentum und Atrophie des Pallidums
Histo:
- Neuronale Tau+ und Gallays+ Einschlüsse (nur schwach Ubiquitin+) als basophile, runde oder globose tangles: Hirnstamm, Basalganglien, Substantia nigra. Im Isokortex dagegen eher deutlich geringer als bei CBD oder AD.
- flame-shaped, coiled NFTs: Cortex
- Gliale Tau-Einschlüsse (tufted astrocytes: spezifisch, diese besser in Gallays als Tau-Färbungen erkennbar), meist in Basalganglien und präzentralem Cortex, dornenartige Astrozyten, meist subpial oder subependymal, coiled bodies in Oligodendrozyten und neuropil threads in Basalganglien, Substantia nigra und deutlich geringer auch kortikal.
- Neuronenuntergang, Astrogliose: Hirnstamm, Basalganglien, Kleinhirn
Diagnostische Kriterien:
- Hohe Zahl von Tangles & Threads: Pallidum, Ncl. subthalamicus, Substantia nigra, Pons. Locus coeruleus, Nucl. Ruber, Nucl. Dentatus, Hirnnervenkerne
Und:
- Niedrig bis hohe Tangle-Formationen: Striatum, Ncl. oculomotorius, Medulla, Nucleus Basalis Meynert, Hippocampus, Präfrontaler Kortex
- Occipitaler und cerebellärer Kortex ist nicht betroffen. Nur selten ballonierte Neurone oder Alzheimer-assozierte Veränderungen.
Differentialdiagnosen: Alzheimer: kann auch mal Tangles im Hinstamm haben, neuritische Plaques (beta-Amyloid!) CBD: ballonierte Neurone, Astrocytic plaques: Tau-Einschlüsse cerebral, Substantia nigra, Locus coeruleus FTDP-17: Reichlich Tau Postencephalitischer Parkinsonismus: Kortikale Pathologie, Klinik: pat sind mind. 60 Jahre oder älter
Verteilungsmuster: A (klassisch, frontal), B: (pallidoluysonigral)
Ausschluss: Pick, MSA, CJD, Alzheimer, Vaskuläre Ursachen
Corticobasale Degeneration (CBD)
[Bearbeiten]Syn: kortikonigrale Degeneration
Epidemiologie: um das 60 Lj. Krankheitsdauer 6-10 Jahre, nahezu immer sporadisch auftretende TAUPOATHIE.
Klinik: asymmetrischer akinetisch-rigider Parkinsonismus, progressive Aphasie, Rigidität, Dystonie (mit Kontrakturen), Rhythmische Myoklonien, alien limb Phänomen, Demenz vom frontobasalem Typ
Makro: asymmetrische kortikale Atrophie mit frontotemporaler Betonung, Depigmentierung der Substantia nigra, Verdünnung des vorderen Balkens und des kortikalen Bandes möglich
Histo:
- Geschwollene korticale Neurone (NF-positiv): achromatische/ballonierte Neurone (III-VI) mit zytoplasmatischen Vakuolen, peripheren Kernen und homogenem Zytoplasma, häufig im Gyrus cinguli, Inselrinde, Amygdala, Claustrum, auch im Gyrus frontalis
- Reichlich Tau-positive neuronal threads in der Rinden-Mark-Grenze und Basalganglien, Tau-positive Glia (astrocytic plaques ohne core wie bei PSP), coiled bodies, thorn shaped astrocytes im Marklager, filamentöse Einschlüsse in den Neuronen des Kortex und Basalganglien, der Hippocampus und das Kleinhirn können unauffällig imponieren
- Tau-positive Einschlüsse in der Substantia nigra, ventrolaterale Thalamuskerngebiete und Nucleus ruber.
- Superfizielle Mikrovakuolationen, Astrozytose, Silberkörnchen
DD: PSP: eher symmetrisch, in der Regel Kortex nicht oder nur mild betroffen, Tangles auch im Ncl. dentatus des Kleinhirns, Neuropil threads außerhalb des Diencephalons nur gering ausgeprägt FTDP-17: autosomal-dominante, familiäre Formen Pick: kann auch geschwollene Neurone haben, aber das Vorhandensein von Pick-Bodies ist nicht kompatibel mit einer CBD.
Prionenerkrankungen
[Bearbeiten]Syn: Transmissible espongiform encephalopathy (TSE)
Ep: Mortalität: 1.5 Fälle / 1 Mio Bevölkerung pro Jahr
Ät.: Sporadisch: 85%, Genetisch: 10% (autosomal dominante Prion-Protein-Mutation), iatrogen: (chirurgische Instrumente, Wachstumshormongaben, Cornea- und Duratransplantation), infektiös: Kuru (ritueller Kannibalismus in Papua-Neuguinea), BSE-Übertragung durch Tiermehlverfütterung)
Pg.: Physiologisch im Körper vorkommende, aber fehlgefaltete Prion-Proteine mit gesteigerter Ausbildung von Beta-Faltblattstrukturen und Neigung zur Polymerisation bilden wasserunlösliche, protease- und lösungsmittelresistente Ablagerungen. Die Prion-Partikel können normal aufgebaute Proteine umfalten und dadurch eine fatale Kettenreaktion in Gang setzen. Bei langer Inkubationsdauer ist der klinische Verlauf relativ kurz.
Mikro: Spongiöse Veränderungen (Vakuolisation der Neurone), Neuronenverlust, astrozytäre Gliose und Mikrogliaaktivierung, Nachweis des pathologischen Prionproteins (PrP-res) evtl.plaqueförmige Ablagerungen (Gerstmann-Sträussler-Scheinker-Erkrankung), Kuru-Plaques (Kuru) und floride Plaques (vCJD).
Einteilung:
- sporadische Creutzfeld-Jakob-Krankheit (sCJD)
- familiäre Creutzfeld-Jakob-Krankheit (fCJD)
- Gerstmann-Sträussler-Scheinker-Krankheit (GSS): 5%-10% aller Prionenerkrankungen
- Familiäre fatale Insommnie (FFI): thalamische Variante der CJD
- iatrogene CJD (iCJD): 400 Fälle bekannt
- neue Variante CJD (vCJD): 200 Fälle aus 10 Ländern bekannt
- Kuru
Tierische Prionenerkrankungen: Scrapie (Schafe), Chronic wasting disease (CWD) bei Elchen, Bovine spongioform encephalopathy (BSE) bei Kühen, feline spongioform encephalopathy (FSE) bei Katzen.
Hinweis: Formalinfixierung ist zur Dekontamination des Gewebes nicht ausreichend. Bei Verdacht auf Prionenerkrankung ist daher das Gewebe zusätzlich noch für 30 Minuten in 96% Ameisensäure zu inkubieren.
Weblink: http://www.prionforschung.de/
CREUTZFELDT-JAKOB-Krankheit (CJD)
[Bearbeiten]Ep.: Typischerweise zwischen 50-70 Lj.
Genetik: Polymorphismus auf Codon 129: 90% der sporadischen Fälle sind homozygot (entweder V/V oder M/M)
Klinik: Psychiatrische Verhaltensauffälligkeiten mit rascher Entwicklung von Demenz, Ataxie, Myoklonien, Rigor. Heidenhain Variante (kortikale Blindheit), Brownell-Oppenheimer-Syndrom (cerebelläre Symptome). Periodische triphasische Komplexe im EEG, Nachweis von 14-3-3 im Liquor, T2-Hyperintensitäten im Thalamus ("pulvinar sign") bei vCJD bzw. T2-Hyperintensitäten des Ncl. caudatus und Putamen bei sCJD.
Makro: Hirnatrophie mit Ventrikelerweiterung unter Aussparung des Hippocampus.
Mikro: Spongiforme Gewebsauflockerung mit grober, teils konfluierender Vakuolisation der grauen Substanz, Neuronenverlust, Astrozytenvermehrung (Gliose), Prionenablagerungen (Plaques finden sich nur im M/V2 Subtyp). Elektronenmikroskopischer Nachweis Tubulovesikulärer Körperchen.
Immuno: Nachweis PrP: a)diffus/synaptisch/granulär, b) perineuronal, c) axonal, d) grobfleckig, e)plaqueförmig
Einteilung der Subtypen (nach Polymorphismus auf Codon 129):
- M/M1 (57%): cerebral-occipital, cerebellär, PrP synaptisch, perivakuolär
- M/M2 (7%): cerebral-entorhinal, PrP perivakuolär
- M/V1 (6%): cerebral-occipital, PrP synaptisch
- M/V2 (14%): cererbral-enthorhinal, Thalamus, PrP synaptisch + Kuru-Plaques
- V/V1 (2%): cerebral-frontal, Striatum, PrP synaptisch, etwas früherer Erkrankungsbeginn
- V/V2 (14%): Cerebellär, Striatum, Thalamus, PrP perineuronal, synaptisch, plaqueförmig
M/M1 und M/V1 zählen zur klassischen Form der CJD
Prg.: Tod meist innerhalb eines Jahres.
familiäre Prionenerkrankungen
[Bearbeiten]Die familiären Formen machen 10-15% aller Prionenerkrankungen aus und werden meist autosomal-dominant vererbt. Es sind sowohl Punkt-Mutationen, Deletionen und Insertionen bekannt. Klinisch werden folgende Phänotypen unterschieden
- familiäre CJD: Mutationen des Prionbroteins: E200K, D178N, V210I, seltener auch: G114V, R148H, V180I, T183A, M232R
- GSS: Typischerweise P102L, seltener P105L, A117V, 198S, Q217R unter anderem
- FFI: Typischerweise D178M
- Pionprotein-Amyloidangiopathie (PrP-CAA)
Histologisch imponieren die familiäre CJD-Fälle wie sporadische CJD Fälle, bei der GSS finden sich ausgedehnte multizentrische Plaque-Formationen bei nur wenigen spongiösen Veränderungen, bei er FFI dominieren ein ausgeprägter Neuronenverlust und Astrogliose des Thalamus, während bei der PrP-CAA sich Prionen-Protein-Ablagerungen in den Gefäßen sowie Tau-positive Neurofibrilläre Tangles nachweisen lassen.
Neue Variante der CREUTZFELDT-JAKOB-Krankheit (vCJD)
[Bearbeiten]Ät.: Vermutlich BSE-assoziiert, Übertragung auch über Bluttransfusionen[2]
Klinik: Unterschiede zur klassischen CJD: früherer Beginn (18 - 41 Lj.), längerer Verlauf, mit psychiatrischen Symptomen, keine EEG-Anomalien, Strukturunterschiede.
Histo: Spongiose, Neuronenverlust, Astrogliose sowie der Nachweis florider Plaques (fibrilläre Amyloid-Deposits mit spongiösem Halo) im ZNS. Nachweis von PrP in dorsalen Ganglien, Keimzentren der Tonsille und Lymphknoten.
Trinukleotid-Erkrankungen
[Bearbeiten]Erkrankungen bei denen repetive Genabschnitte (Basentripletts) über die normale Anzahl hinaus vermehrt sind. Bestimmte Erkrankungengen sind durch einen Funktionsverlust des expandierten Gens gekennzeichnet (Friedereich-Ataxie, FXTAS). Im Gegensatz hierzu wird bei den Polyglutaminerkrankungen (CAG-Expansionen) ein "toxic gain of function" angenommen. Die Eigenschaft, dass ein früherer Erkrankungsbeginn mit der Anzahl der Repeats zunimmt, wird als Antizipation bezeichnet.
Die Spinobulbäre Muskelatrophie ist ebenfalls eine Trinukleotiderkrankung und wird im Kapitel Motoneuronerkrankungen beschrieben.
Chorea HUNTINGTON
[Bearbeiten]Huntington's disease, veraltet: Veitstanz
Ep.: 1:10.000, Erstmanifestation: ca. 40 - 50 Lj., Krankheitsdauer 10-15 Jahre
Ät.: Autosomal-dominant-erbliche Expansion von Trinukleotidsequenzen mit Verlust GABAerger Neurone des Neostriatums.
Genetik:
- Physiologische Wiederholungsfrequenz des Basentripletts CAG im Huntingtin-Gen auf Chromosom 4p16.3
- Normal: 10 - 26, Instabiler Bereich: 27-35, unvollständige Penetranz: 36 - 39, Manifestation: 40 - 250 (korreliert mit Erstmanifestationsalter). Juvenile Chorea Huntington bei > 60 CAG-Tripletts.
- Antizipation besonders bei väterlicher Transmission (CAG-Repeats verlängern sich in der Spermiogenese).
Pg: Das Triplett CAG kodiert für die Aminosäure Glutamin. Der erhöhte Glutamineinbau in das Protein Huntingtin verändert seine biochemischen Eigenschaften, z.B. seine Abbaufähigkeit im Proteasom. Es kommt zu amyloidähnlichen Einschlusskörperchen aus Polyglutamin-Aggregaten im Striatum mit konsekutiver Nervenzellschädigung.
Makro: Atrophie des Nucleus caudatus (Neuronenverlust, Gliose). Einteilung nach Vonsattel: 0 keine makroskopischen Veränderungen, 1: nur mikroskopisch sichtbarer Neuronenverlust 2: Caudatumkopf noch konvex, 3: Caudatumkopf abgeflacht, 4: Caudatumkopf konkav. Im spätstadium komplette Hirnatrophie (Gewicht bis zu 900-1000 g möglich).
Mikro: Neuronenverlust im Neostriatum. Reaktive Astrogliose und Mikrogliaaktivierung. Der Nucleus accumbens ist erst in fortgeschrittenen Stadien (3 & 4 nach Vonsattel) betroffen.
Immuno: Kleine Ubiquitin-, Huntingtin- oder FUS-positive intranukläre Einschlüsse in den Neuronen. GFAP-positive reaktive Astrozyten, Reduzierte Synaptophysin-Expression im Kortex.
Klinik: Progredienter neurologischer Abbau über 10 bis 20 Jahre mit letalem Ausgang. Psychiatrische Symptome (unspezifisch, Depression, Psychosen, im Verlauf Demenz). Choreatiforme Bewegungsstörungen, Athetose, Dysarthrie. Huntington-Patienten haben deutlich höhere Suizidraten als die Normalbevölkerung.
DD: FTLD, Pick, DRPLA, Neuroakanthozytosen, andere choreatiforme Erkrankungsursachen
Wikipedia: Chorea Huntington.
Weblink: OMIM - Huntington disease (HD)
 |
FRIEDREICH-Ataxie (FRDA1)
[Bearbeiten]Ep.: 1 : 150.000 Geburten, Manifestationsalter 6. bis 14. Lebensjahr
Ät.: Autosomal-rezessive Trinucleotiderkrankung, betroffen sind GAA-Repeats im pleiotropen mitochondrialen Frataxin-Gen. Die Expression des 210 Aminosäuren langen Proteins fällt ab unter 10% der Norm.
Pg: Störung der Eisenhomöostase und Anreicherung in den Mitochondrien -> Dysfunktion -> Degeneration bes. energieintensiver Gewebe.
Klinik: Ataxie, Okulärer Nystagmus, Sprachschwierigkeiten, Skoliosen, Rollstuhlpflichtigkeit im Erwachsenenalter, Häufiges Mitauftreten von Diabetes mellitus
Morphologie:
- Tractus spinocerebellaris -> Gang-, Stand- und Extremitätenataxie
- Hinterstränge -> Vibrationsempfindung gestört
- Hinterwurzel -> Reflexabschwächung, Sensibilitätsstörungen
- Kleinhirn (spät) -> Dysarthrie, skandierende Sprache, „Löwenstimme“, Augenbewegungsstörungen, Nystagmus, Ataxie
- Weitere nervale Störungen: Spastische Pyramidenbahnzeichen, Neuropathie, Friedreichfuß (supinierter Hohlfuß + Spitzfuß), Hör- und Sehschwäche, Hirnleistungsstörungen bis zur Demenz.
- Sonstiges: Kardiomyopathie, Diabetes mellitus, Knochenveränderungen (Skoliose)
Das zweite motorische Neuron scheint nicht betroffen zu sein (?).
Makro + Histo: Atrophie des Vermis, Waller'sche Degeneration der posterioren und lateralen Trakte, Verlust des undulierenden Bildes des Nucleus dentatus, granuläre Eisenablagerungen im Myokard und Leber (nicht jedoch im ZNS)
Prg.: Verlauf langsam progredient, Tod mit 40 bis 45 Lj.
DD.: Funikuläre Myelose bei B12-Mangel
Weblinks: OMIM - Friedreich ataxia (FRDA1), OMIM - FRDA2
Spinozerebelläre Ataxie (SCA)
[Bearbeiten]Ät: verschiedene Gendefekte bekannt (SCA 1-26), häufigste Form mit 40%: SCA3 (Machado-Joseph-Erkrankung (MJD)), Nur SCA 1, 2, 6, 7 und 17 zählen im engeren Sinne zu den Trinukleotiderkrankungen.
Klinik: motorische Ataxien, Nystagmus, Parkinsonismus, Autonome Dysfunktionen
Makro: Olivopontocerebelläre Atrophie bei SCA1, SCA2 und SCA7, rein cerebelläre und oliväre Atrophie: SCA6, SCA17. Das Hirngewicht ist bei SCA2 deutlich reduziert (unter 1000 g), bei SCA3 und 6 normal bis marginal reduziert.
Histo: Pathologische Zellfortsätze der Purkinjezellen im Kleinhirn. Der Neuronenverlust im Nucleus dentatus ist bei SCA3 am ausgeprägtesten. Atrophie der dorsalen Bahnen des Rückenmarkes sind bei SCA2 und SCA3 ausgeprägt, bei SCA6 imponiert das Rückenmark normal.
Immuno: Ubiquitin- und FUS-positive Einschlüsse bei SCA, die auch mit anti-Polyglutamin angefärbt werden können (SCA1+2 nuklär, SCA6 zytoplasmatisch)
Wikipedia: Spinozerebelläre Ataxie
Dentato-rubrale Pallido-Luysische Atrophie (DRPLA)
[Bearbeiten]autosomal-dominant vererbt: CAG-Repeat-Expansion im Atrophin-1-Gen (normal: 7-55, FRDA1: 66-1700 Repeats)
Klinik: progrediente cerebelläre Ataxie, Myoklonusepilepsie, Choreoathetose und Demenz
Makro: Extensive Atrophie des Pons, Pallidum, Ncl. subthalamicus
Histo: Astrozytose, Neuronenverlust im Pallidum, Ubiquitin-positive Einschlüsse in Neuronen des Nucleus dentatus.
Paraneoplastische Kleinhirndegeneration
[Bearbeiten]Ep.: Bei ca. 9 % der Malignomerkrankungen (autoptisch).
Ät.: Paraneoplastische Autoantikörper, z.B. α-Hu (kleinzelliges Bronchialkarzinom), α-Yo (Ovarialkarzinom).
Mikro: Diffuse Rindenatrophie (Purkinje-Zellen), entzündliche Infiltrate. Neuropathie, Gangliopathie.
Klinik: Kleinhirnsyndrom (Rumpfataxie, Dysmetrie, Dyssynergie (Rebound-Phänomen), Intentionstremor (antagonistisch, proximal, 2-3Hz), Nystagmus, sakkadierte Blickfolge, Oszillopsien, skandierendes Sprechen, Dysarthrie).
A-α-Motoneuron-Erkrankungen
[Bearbeiten]idiopathisch: Amyotrophe Lateralsklerose erblich: Spinale Muskelatrophie (rezessiv), familiäre ALS (dominant), Kennedy's Disease (x-chromosomal) sekundär: Poliomyelitis, HIV-Infektion, Paraneoplastisch, Toxisch
Amyotrophe Lateralsklerose (ALS)
[Bearbeiten]amyotrophic lateral sclerosis
Etym.: A myo trophie = Fehlende „Ernährung“ des Muskels. Lateralsklerose = seitliche Vernarbung.
Ep.: Inzidenz 1-2:100.000, Prävalenz 5:100.000
Ät.: 95 % sporadisch (sALS). 5 % familiär (fALS). Mutierte Gene bei fALS sind: C9ORF72, TDP-43, FUS/TLS, Optineurin, VCP und ANG.Damit überlappt sich das Krankheitsbild der ALS mit FTD-ALS, bei der die ZNS-Beteiligung im Vordergrund steht. Am häufigsten sind C9ORF72-Mutationen, für die zytosolische Cu,Zn-Superoxiddismutase 1 (SOD-1) sind hier mittlerweile mehr als 100 Mutationen bekannt, die meist autosomal-dominant weitergegeben werden. Pg.: Degeneration des 1. motorischen Neurons (Pyramidenbahn, Tractus corticobulbaris) und/oder des 2. Neurons (α-Motoneuron im Vorderhorn des Rückenmarks bzw. im Stammhirn). Die Degeneration ist nicht streng systematroph d.h. hier auf die Motoneurone beschränkt, in 5 % der Fälle findet sich auch eine frontotemporale Demenz.
Makro: Atrophie der vorderen Spinalnervenwurzeln, Atrophie der Vorderhörner, tastbare Sklerosierung der lateral im weißen Rückenmark gelegenen Pyramidenbahn. Evtl. Atrophie des Gyrus praecentralis.
Immuno: Ubiquitin-positive Einschlüsse in den Motoneuronen, Nachweis von Mikrogliaaktivierung mit CD68
Mikro: Degeneration der Vorderhorn-Motoneurone (Neuronopathie) mit Bunina-bodies, hyaline Einschlüsse, axonale Spheroide. In der Markscheidenfärbung ist die Atrophie der Pyramidenbahn sichtbar. Muskel: Neurogene Muskelatrophie (gruppierte Myozytenatrophie der betroffenen motorischen Einheiten), reaktive Hypertrophie nicht betroffener Muskelzellen.
Prg.: Meist rasch progredient, letal (CO2-Narkose im respiratorischen Versagen), mittlere Überlebenszeit nach Diagnose ca. 3 Jahre, selten bis zu 15 Jahren und länger (Bsp. Stephen Hawking, bekannter Physiker).
Weblink: OMIM - Amyotrophic lateral sclerosis
Spinobulbäre Muskelatrophie (SMBA)
[Bearbeiten]Kennedy's disease'
Ät: Triplett-Expansion (CAG) des Androgenrezeptors, X-chromosomaler Erbgang
Histo/Immuno: Nukläre Einschlüsse: Ubiquitin- und Androgenrezeptor-positiv
Hereditäre spastische Paraparese (HSP)
[Bearbeiten]Pg.: Schädigung des oberen Motoneurons, langsam progressiv, verschiedene genetische Formen bekannt
Klinik: Pes cavus
Histo: Neurogene Muskelatrophie, Degeneration der kortikospinalen und posterioren Bahnen, im Kleinhirn: Purkinjezellverlust, Degeneration des Ncl. dentatus.
Spinale Muskelatrophie (SMA)
[Bearbeiten]Spinal muscular atrophy
Erkrankungen mit Untergang der (unteren) α-Motoneurone. Bei Kleinkindern Arhrogyroposis, floppy infant, bei Schulkindern: Skoliosen, Kontrakturen.
- Typ I - WERDNIG-HOFFMAN (Akute infantile SMA) - Erstes Lebensjahr
- Typ II - Chronische infantile SMA (Intermediäre SMA) - Erstes Lebensjahr
- Typ III - KUGELBERG-WELANDER (Juvenile SMA) - Kindesalter
- Typ IV - Adulte Form
Histologisches Bild der Muskulatur: Neurogene Muskelatrophie.
Weblinks: OMIM - SMA 1, SMA 2, SMA 3, SMA 4
Alimentäre und toxische Erkrankungen
[Bearbeiten]Funikuläre Myelose
[Bearbeiten]Ät.: Vitamin B12 (Cobalamin)-Mangel, Typ A-Gastritis oder Z.n. Magenresektion (Intrinsic factor-Mangel), Z.n. Ileumresektion, vegane Ernährung.
Klinik: Schleichender Beginn, Mattigkeit, spinale Ataxie bei Ausfällen des Lage-, Berührungs- und Vibrationsempfindens (Hinterstränge), organische Psychose, megaloblastäre Anämie, HUNTER-Glossitis, strohgelbe Hautfarbe (Anämie + Ilkterus).
Histo: Demyelinsierung der Hinterstrangbahnen, besonders cervico-thorakal, Spongiose
Pellagra
[Bearbeiten]Ät: Tryptophan/NAD-Mangel Histo: Chromatolyse der Betz-Zellen des Motokortex, Verlust pontiner NEurone sowie Motoneurone des Rückenmarkes.
DD: Spinale Muskelatrophie
WERNICKE-Enzephalopathie
[Bearbeiten]Ät.: Thiamin-Mangel (Vitamin B1-Mangel).
Makro: Kleine Einblutungen und bei chronischer Dauer: Atrophien, typischerweise Corpora mamillaria und periaquäduktale Bereiche des Pons, bei Wernicke-KORSAKOW-Syndrom' zusätzlich Kleinhirnoberwurmatrophie
Histo: Nekrosen, Vakuolisierungen, Makrophagenansammlungen um Gefäße, Endothelhyperplasien, petechiale Einblutungen mit Hämosiderinbalgerungen, Neuronenverlust
Klinik: Ataxie, Doppelbilder, Nystagmus, vegetative Störungen, periphere Neuropathien. Überlappung mit dem psychiatrischen Krankheitsbild des alkoholbedingten KORSAKOW-Syndroms mit gleicher Ätiologie und der Trias Amnesie, Desorientierung, Konfabulation.
Vitamin E-Mangel
[Bearbeiten]Ät: intestinale Malabsorption: mukoviszidose, biliäre Atresien, Abetalipoproteinämie (Bassen-Kornzweig Syndrom)
Histo: Neuronenverluste der dorsalen ganglionären Neruone (Hinterstrangbahnen, Ncl. gracilis und cuneatus) mit neuroaxonalen Schwellungen.
Hypoglykämie
[Bearbeiten]Ät: Verlust der insulinabhängigen Glukoseaufnahme ins ZNS, bei weniger als 25mg/100ml sind Schäden schon nach 1-2 Stunden zu beobachten
Histo: Hypereosinophile Neurone im Sektor CA1 des Hippocampus sowie Nucleus dentatus sowie Lamina 3,5 und 6 des Neocortex.
DD: Hypoxie, Infarkt
Hepatische Enzephalopathie
[Bearbeiten]Ät: Versagen der Leberfunktion führt zu Ammoniakanstieg im Gehirn mit toxischer Wirkung
Klinik: "flapping tremor"
Histo: Alzheimer-Typ-II-Glia: Astrozyten mit vesikulärem rundlichen Kern, glasigem Chromatin im Cortex Opalski Zellen: bizarr-geformte eosinophile Kerne im Ncl. caudatus und Putamen
ZNS-Schäden bei Alkoholabusus
[Bearbeiten]Ät.: Langjähriger Alkoholabusus.
- Wernicke-Enzephalopathie
- Atrophie des Kleinhirns, v.a. Oberwurm
- Marchifava-Bigami-Erkrankung: Diskoloration und Kavitätenbildung des Balkens
- Morel-Syndrom: kortikale laminare Nekrosen der Schichten III und IV
- Fetales Alkoholsyndrom: Mikrozephalie, Neuronale Heterotopien
Kleinhirnatrophie bei Zöliakie
[Bearbeiten]cerebelläre Atrophie mit Purkinje-Zell-Verlust, Bergmann'sche Gliose, lymphozytäre infiltrate, Neuronenverlust, Gliose, Kalzifikationen
Sonstiges
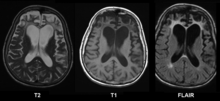
[Bearbeiten]Hippocampus-Sklerose
[Bearbeiten]mesial sclerosis
Syn.: Ammonshornsklerose, mesiale temporale Sklerose
Makro: Hippocampusatrophie möglich
Mikro: Neuronenverlust und Gliose des Hippocampus und angrenzender Strukturen aufgrund peristierender Epilepsien. Zur Beurteilung der Präparate ist eine koronare Schnittführung notwendig. Der Neuronenverlust ist in Sektor CA1 am ausgeprägtesten. Synaptophysin ist oft entsprechend reduziert. Die Astrogliose kann mittels GFAP visualisiert werden. Atypische Neuronenverluste in den Sektoren CA2 bis CA4 zeigen eine schlechtere Prognose.
Bildgebung: Unscharf begrenzte Hyperintensitäten in T2-gewichteten Bildern.
Klinik: Temporallappenepilepsie.
Tabelle (Quelle: Mesiale temporale Sklerose, Autor Benutzer:Marvin 101):
| Typ | Verteilungsmuster | Häufigkeit | Anfallsfreiheit (12 Monate postoperativ) |
|---|---|---|---|
| 1A | Nervenzellausfälle im Bereich der CA1-Region, moderate Ausfälle in CA2, CA3 und CA4 (klassisches Verteilungsmuster) | 19% | 72% |
| 1B | Nervenzellausfälle im Bereich der CA1-Region, deutliche Ausfälle in CA2, CA3 und CA4 (schwere Hippokampussklerose) | 53% | 73% |
| 2 | isolierte Nervenzellausfälle im Bereich der CA1-Region, keine wesentlichen Ausfälle in CA2, CA3 und CA4 (CA1-Sklerose) | 6% | 67% |
| 3 | Nervenzellen im Bereich der CA1-Region erhalten, Ausfälle in CA2, CA3 und CA4 (Endblattsklerose) | 7% | 29% |
 |
 |
 |
Literatur:
- Blümcke I, Pauli E, Clusmann H, et al.. “A new clinico-pathological classification system for mesial temporal sclerosis”. Acta Neuropathol., 113:235–44, March 2007. DOI:10.1007/s00401-006-0187-0. PMID 17221203.
Weblinks
[Bearbeiten]Quellen
[Bearbeiten]- ↑ Höglinger GU et al. “The pRb/E2F cell-cycle pathway mediates cell death in Parkinson's disease”. Proc. Natl. Acad. Sci. USA, [Epub Feb 21 2007]. DOI:10.1073/pnas.0611671104.
- ↑ ?. “Clinical presentation and pre-mortem diagnosis of variant Creutzfeldt-Jakob disease associated withblood transfusion”. The Lancet, 368(9552):2061-2067, Dec 2006. - rme. “Großbritannien: Dritter Patient nach Bluttransfusion an vCJD gestorben”. Deutsches Ärzteblatt, Dez 8 2006.
Buch-Navigation