Pathologie: Knochen
Buch-Navigation
Der Knochen
[Bearbeiten]Physiologie:
- Organischer Anteil: Kollagen I, Osteopontin, -calzin, -nektin; Mineralischer Anteil: Calziumhydroxilapatit
- Spongiosa (Schwamm) innen - Compacta/Corticalis außen
- ständiger Umbau durch Osteoblasten und Osteoklasten
- Knochenentstehung enchondral (über Knorpel) oder desmal (direkt aus Bindegewebe)
Osteogenesis imperfecta
[Bearbeiten]Syn.: „Glasknochenkrankheit“
Ep.: 1:15.000 bis 1:20.000
Genetik: Die meisten Formen sind autosomal-dominant vererbt, meist Neumutation.
Pathogenese: In 85 - 90 % der Fälle Störung der Kollagensynthese durch Mutationen in den Kollagen-Genen COL1A1 (17q), COL1A2 (7q). In einer seltenen Variante der letalen Form mit autosomal-rezessivem Erbgang konnten Mutationen im „cartilage associated protein“ (CRTAP), das für die posttranslationale Prolyl-3-Hydroxylierung des Kollagens zuständig ist, als Ursache identifiziert werden.[1]
Klinik: Multiple Frakturen („Glasknochenkrankheit“), blaue Skleren, mit oder ohne Dentinogenesis imperfecta.
Typ I (Osteogenesis imperfecta tarda, Typ Lobstein)
Häufigste Form
Klinik: U.U. milder Verlauf. Variable Frakturrate im Kindesalter, mit der Pubertät abnehmend (DD: Kindesmißhandlung!). Regelrechte Knochenheilung -> normale Endgröße, keine Deformierung, in 30-50% Entwicklung einer Innenohr- oder Mittelohrhörstörung. Untergruppe A mit, B ohne Dentinogenesis imperfecta (grau-bläuliche Zahnverfärbung, Schmelzabsplitterungen, deformierte Zahnwurzeln).
Typ II (Osteogenesis imperfecta congenita)
Schwerste Form
Genetik: autosomal-dominant (Typ III auch autosomal rezessiv), meist Neumutation
Makro: Proportionierter Kleinwuchs, dreieckförmiges Gesicht, dünne blaue Skleren, weicher Kautschuk-/Papierschädel. Die Extremitäten sind verkürzt, Faltenbildung der Haut, multiple intrauterin entstandene Frakturen bes. der langen Röhrenknochen (Rö: Ziehharmonika-Knochen) und Rippen (Serienfrakturen, wulstartige Auftreibung der Bruchstellen wegen überschießender Kallusbildung (Kollagen III)). Die Haut ist verdünnt, rissig, instabil.
Mikro: Osteoid vermindert, Haut verdünnt (Kollagengehalt vermindert).
Prg.: frühletal, Hirnblutungen unter natürlicher Geburt
Typ III (Osteogenesis imperfecta congenita, Typ Vrolik)
Schwere Form
Genetik: autosomal-dominant (auch autosomal-rezessiv), meist Neumutation
Klinik: Schwere Ausprägung, multiple Frakturen. Fast alle Kinder überleben das Säuglingsalter, Lebenserwartung z.T. eingeschränkt. Im Verlauf schwere Knochenverformungen, Kleinwuchs, starke Verkrümmungen der Wirbelsäule (-> restriktive Ventilationsstörungen), die Skleren sind u.U. unauffällig.
Typ IV: Klinik: Variabler Verlauf, Minderwuchs, weiß bis blass-blaue Skleren, mäßige Frakturen, progressive Extremitätenverformungen, führt oft zur Rollstuhlpflichtigkeit. Unterform B mit Dentinogenesis imperfecta.
Typ V: Klinik: Hypertrophe Kallusbildung nach Brüchen, Verkalkung der Syndesmosen (Membranae interosseae antebrachii et cruris) und metaphysären Bänder. Die Skleren sind unauffällig, keine Dentinogenesis imperfecta.
Typ VI: Klinik: Störung der Knochenmineralisation mit Wirbel-Kompressionsfrakturen und Extremitätendeformierung. Das Vomer kann defekt sein. Die Skleren sind unauffällig, keine Dentinogenesis imperfecta, die alkalische Phosphastase (AP) ist erhöht.
Typ VII: Genetik: autosomal-rezessiv. Klinik: Coxa vara, Extremitätenverkürzung
Weblink: Schweizerische Vereinigung Osteogenesis Imperfecta (SVOI)
 |
 |
 |
Marmorknochenkrankheit
[Bearbeiten]Syn.: Osteopetrose, Morbus ALBERS-SCHÖNBERG
Ep.: Selten
Ät.: Überschießende Knochenbildung, Enzymdefekt der Osteoklasten
Makro: Knochenmark spärlich, vom Knochen verdrängt. Extramedulläre Blutbildung in Leber, Milz (Hepatosplenomegalie), Lymphknoten. Kompakt durchbauter, instabiler Faserknochen (kein Umbau zu lamellärem Knochen). Massive Frakturen.
Mikro: Inkompetente Osteoklasten, fehlende Resorptionslakunen. Weitere Bezeichnung: Morbus Vrolik oder Vrolik Syndrom
Osteoporose
[Bearbeiten]Ät.:
- Primär: Altersinvolution (Involution + Inaktivität + verminderte Proteinsynthese), Abfall der Sexualhormonspiegel, Calcium- und Vitamin-D-Mangel
- Sekundär: Immobilisierung, Morbus Cushing, Hypogonadismus, Diabetes mellitus, Medikamente (Antikonvulsiva, Kortikoide), Alkohol, Hyperthyreose, Hyperparathyreoidismus, chronische Darmerkrankungen, Malabsorption, Nierenerkrankungen, Z.n. Organtransplantation.
Pg.: Parallele Verminderung von Knochenmineralisation und Grundsubstanz.
Makro: Erhaltene äußere Knochenstruktur. Im Wirbelkörper Rarifizierung der quervernetzenden und Sklerose der vertikalen Trabekel. Verbiegung der Wirbel, Deckplatteneinbrüche, Fischwirbel.
Mikro: Verminderte Knochendichte (Knochenmasse pro Volumeneinheit), normale Mineralisierung, stummelförmige sklerosierte Knochenbälkchen.
Klinik: Rückenschmerzen, Frakturneigung. Laborchemisch normale Kalzium- und AP-Spiegel.
SF: Kortikoidinduzierte Osteoporose
Ät.: Kortisonlangzeittherapie bei chronischer Polyarthritis (früher, heute idR. Therapie mit Basistherapeutika wie MTX, Kortison nur noch im Schub oder sehr niedrig dosiert als Begleitmedikation) und Transplantation.
Mikro: Keine Sklerose, rarifizierte, dünne, girlandenartige Trabekel mit rauher Oberfläche (Osteoklastenaktivität), einkernige monohistiozytäre Zellen (Vorläufer der durch Verschmelzung entstehenden mehrkernigen Osteoklasten).
SF: Juvenile Osteoporose
Selten
Kollagen-I-Mangel (fließender Übergang zur Osteogenesis imperfecta)
Osteodystrophia fibrosa cystica generalisata
[Bearbeiten]Syn.: Osteitis fibrosa, Osteitis fibrosa cystica.
Syn.: Morbus VON RECKLINGHAUSEN (gleiches Syn. wie NF1!!)
Ät.: Hyperparathyreoidismus.
Lok.: Bes. lange Röhrenknochen, Becken, Wirbelsäule.
Pg.: Massive Resorption (osteopenische Erkrankung), führt zum histologischen Bild der dissezierenden Fibroosteoklasie.
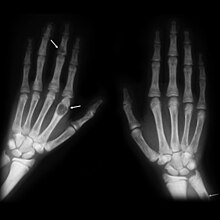
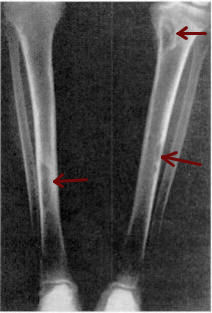
Makro: Herdförmige Läsionen, sog. „braune Tumoren“. Zystische mit Granulationsgewebe gefüllte Hohlräume.
Histo: Dissezierende Fibroosteoklasie: Resorptionszonen mit Osteoklastenvermehrung und Tunnelierung der Knochenbälkchen, zusätzlich Endostfibrose, die auf die Markräume übergreifen kann. Zahlreiche Cluster aus Riesenzellen von unauffälliger Gestalt.
Labor:
- Primärer Hyperparathyreoidismus: PTH erhöht, Hyperkalzämie, Hypophosphatämie.
- Sekundärer Hyperparathyreoidismus: PTH erhöht, Hypo- oder Normokalziämie, bei renaler Ursache: Kreatininanstieg, GFR-Reduktion.
DD:
- Riesenzelltumor - „Synzytium“-artiges Erscheinungsbild, laborchemisch keine Hyperparathryoidismus.
- Fibröse Dysplasie - Faserknochen.
- Morbus PAGET - abnorme Osteoklasten.
 |
 |
 |
Rachitis
[Bearbeiten]rickets
Syn.: Englische Krankheit, juvenile Osteomalazie
BC der Vitamin-Biosynthese: 7-Dehydrocholesterol --Haut(UV-Licht/Ringsprengung)--> Cholecalziferol (Vitamin D3) --Leber--> 25-Hydroxicholecalziferol --Niere--> 1,25-Dihydroxicholecalziferol (D-Hormon, Calzitriol). Vitamin D3 wird auch aus der Nahrung aufgenommen.
Ät.: Vitamin-D-Mangel bei Kindern (nutritiv, Lichtmangel).
Ep.: In entwickelten Ländern selten, früher bei Kindern im Bergbau.
Klinik:
- Verminderte Knorpelresorption (enchondrale Ossifikation) und fehlenden Mineralisierung des Osteoids in den Epiphysenfugen -> Ablagerung von osteochondroidem Material -> Auftreibung der Epiphysenfugen und Knorpelknochengrenzen der vorderen Thoraxwand („rachitischer Rosenkranz“).
- Störung der desmalen Ossifikation -> Caput quadratum.
- Verbiegung der langen Röhrenknochen -> Rachitischer Zwergwuchs.
- Evtl. Entwicklung eines Kartenherzbeckens bei der Frau -> Geburtshindernis.
DD:
 |
 |
Osteomalazie
[Bearbeiten]Ät.: Vitamin-D-Mangel beim Erwachsenen (UV-Mangel, Darm-, Nieren-, Lebererkrankungen), Medikamente (Dauereinnahme von Phenytoin bei Kindern und Jugendlichen).
Pg.: Verminderung der Knochenmineralisation bei normaler Grundsubstanz
Makro: Acetabulumprotrusion, Coxa vara.
Mikro: Osteolytisch-sklerotische Umbauzonen (Looser-Milkman-Umbauzonen), breite unmineralisierte Osteoidsäume an den Knochenbälkchen.
Fibröse Dysplasie
[Bearbeiten]Syn.: JAFFE-LICHTENSTEIN-Syndrom, Osteodystrophia fibrosa unilateralis
Ät.: Defekt eines G-Proteins (meist als genetisches Mosaik)
Pg.: Meist einseitige und lokalisierte monostotische Störung der Knochenentwicklung infolge fibröser Dysplasie mit Ersatz des Knochens durch faserreiches Bindegewebe.
Lok.: Tibia, Fibula, prox. Femur, Humerus (Dia- und Metaphysen)
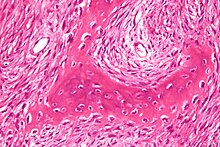
Makro: Meist einseitig und nur eine Läsion (Mosaik). Verbiegung, zystische Auftreibung an Tibia, Fibula oder prox. Femur (Hirtenstab-Femur). Osteolytisch-sklerotische, weiche fibröse Masse (insuffizienter Faserknochen).
Histo: Zahlreich Fibroblasten/Faserstroma zwischen langen girlandenartigen Faserknochenbälkchen, Buchstabensuppe, chinesische Buchstaben.
Mol.path.: In ca. 70% d.F. GNAS Mutation. PMID 22245114
Klinik: Spontanfrakturen, Knochenschmerzen, Deformierung.
SF: Mc Cune-Albright-Syndrom - Polyostotische Fibroplasie, Café-au-Lait-Flecken und endokrine Überfunktion (Pubertas praecox).
Literatur und Weblinks:
- OMIM - McCune-Albright syndrome
- Dumitrescu CE, Collins MT. “McCune-Albright syndrome”. Orphanet J Rare Dis., 3(1):12, May 19 2008. PMID 18489744
 |
 |
 |
 |
 |
 |
Morbus PAGET
[Bearbeiten]Syn.: Ostitis deformans.
Ep.: Alte Männer, um das 70. Lj.
Ät.: Slow-virus?
Lok.: Schädel (DD: Hyperostosis), Wirbelsäule, Becken, Femur, Tibia.
Path.: Gesteigerter Knochenumbau (Knochenumsatz/Remodelling durch Osteoblasten und Osteoklasten um Faktor 10 erhöht) führt zu Knochenverformungen.
Makro: Die Kortikalis ist massiv verdickt, grobsträhniger Umbau. Wirbel quadratisch (Kastenwirbel), bimssteinartig porös. Minderwertiger Knochen, Knochenverbiegung, herdförmige Substanzverluste, Keilwirbel, Frakturen. Im Rö-Schädel sieht man Spikulae.
Mikro: Mosaik/Puzzlestruktur des Knochens, viele Kittlinien, Riesenosteoklasten.
Labor: Alkalische Phosphatase stark erhöht, S-Kalzium normal.
Klinik: Körpergröße nimmt ab, Kopfumfang nimmt zu (der Hut passt nicht mehr), Kyphose, Arme/Beine erscheinen deformiert, diffuse Knochenschmerzen, Schwerhörigkeit.
Kompl.: Pathologische Frakturen, in 5 % nach 8-10 Jahren Übergang in ein PAGET-Sarkom, Arthrose, Wurzelkompressionen, Schwerhörigkeit, Nierensteine.
 |
 |
Morbus SCHEUERMANN
[Bearbeiten]Syn.: Adoleszentenkyphose, juvenile Kyphose
Pg.: Wachstumsstörung eines Wirbelkörpers
Makro: Deckplatteneinbruch, Keilwirbel, verringerte Diskushöhe, SCHMORL-Knötchen, Kyphose.
Aseptische Knochennekrosen
[Bearbeiten]Histo: Leere Osteozytenhöhlen.
 |
 |
 |
Morbus PERTHES
[Bearbeiten]Syn.: Idiopathische juvenile Hüftkopfnekrose
Ep.: 6. - 8. Lebensjahr, bevorzugt männlich. Die Gegenseite kann auch gleichzeitig oder zeitversetzt erkranken. Begleitend Skelettretardierung möglich.
Ät.: Durchblutungsstörung?
Pg.: Stadienhafter Verlauf: 1) Initialstadium: Knochenkern stirbt ab 2) Kondensationsstadium: Knorpel/Hüftkopfkompression -> Sinterung, Deformierung 3) Fragmentationsstadium 4) Reparationstadium: Erholung, neuer Kopfkern, aber in Deformitätsstellung: Pathologische Kongruenz. 5) Ausheilungsstadium
Klinik: Hinken, Hüft-, Oberschenkel- oder Knieschmerzen, eingeschränkte Beweglichkeit (bes. Abduktion und Rotation), Gelenkerguss, Vierer-Test (syn. PATRICK-Test) positiv (Abb.), TRENDELENBURG-Zeichen.
Th.: Containment (Überdachung) des Hüftkopfes z.B. durch intertrochantere Umstellungsosteotomie.
Prg.: Günstiger im jungen Erkrankungsalter. Langzeitfolgen: Funktionsstörung, spät Arthrose, Schmerzen mit 50 bis 60 Jahren.
KÖHLER'sche Erkrankung
[Bearbeiten]Absterben des Knochenkerns
KÖHLER I
Os naviculare des Fußes betroffen, meist um das 14. Lebensjahr nach ausdauernder Belastung (Tanzen).
KÖHLER II
Idem, Os metatarsale II betroffen.
Osteochondrosis dissecans
[Bearbeiten]Gelenkflächennahe Knochennekrose -> Eindringen in den Gelenkspalt (Gelenkmaus) -> Schmerzen, Arthrose
Morbus KIENBÖCK
[Bearbeiten]Bei Os-lunatum-Frakturen.
Morbus OSGOOD-SCHLATTER
[Bearbeiten]Aseptische Knochennekrose der Tibiaapophyse
Adulte aseptische Knochennekrosen
[Bearbeiten]Ät.: Kortisontherapie, Alkoholismus, Taucher-Krankheit.
Fibrodysplasia ossificans progressiva (FOP)
[Bearbeiten]Syn.: MÜNCHMEYER-Syndrom
Die FOP ist eine sehr seltene Erkrankung, die mit einer zunehmenden Verknöcherung des Stütz- und Bindegewebes einhergeht.
Ep.: Weltweit gibt es etwa 2.500 Patienten
Ät.: Ursache ist meist eine Punktmutation in Position 206 in einem kurzen Gen auf Chromosom 2, das für den Activin Receptor Type IA (ACVR1) kodiert, ein Protein aus 509 Aminosäuren und eines von drei bekannten BMP Typ I Rezeptoren. Der Ligand bone morphogenetic protein (BMP) ist an der Knochenheilung beteiligt.
Klinik: Die Kinder sind bis auf eine verkürzte Großzehe bei der Geburt unauffällig. Bereits im Kleinkindalter führt jede kleine Traumatisierung (Injektionen, Stöße, Stürze) an der betroffenen Stelle zu einer Umwandlung des Bindegewebes in Knochen. Die Erkrankten bilden quasi ein zweites Skelett aus. Eine Entfernung des neugebildeten Knochens ist daher auch nicht möglich.
Siehe auch:
- Kaplan FS et al. “The Molecules of Immobility: Searching for the Skeleton Key”. UPOJ, 11:59-66, 1998.
- Unterbörsch H. “Fibrodysplasia ossificans progressiva: Mißbildungen der Großzehe als Hinweis”. Deutsches Ärzteblatt, 26:A-1764 / B-1514 / C-1406, Jul 1996.
Quellen
[Bearbeiten]- ↑ Barnes AM et al. “Deficiency of cartilage-associated protein in recessive lethal osteogenesis imperfecta”. N Engl J Med, 355(26):2757-64, Dec 28 2006.
Buch-Navigation
